在胶片冲洗时可用硫代硫酸钠(Na2S2O3)做定影液,与胶片上未曝光的AgBr反应生成可溶性离子Ag(S2O3)23-。该有关过程的离子方程式不合理的是
A.H2S2O3溶液显弱酸性的原因是:H2S2O3 H+ + HS2O3- H+ + HS2O3- |
B.Na2S2O3溶液显碱性的原因是:S2O32-+2 H2O  H2S2O3 + 2OH- H2S2O3 + 2OH- |
C.Na2S2O3和AgBr反应的离子方程式是:2S2O32-+ AgBr  Ag(S2O3)23- + Br- Ag(S2O3)23- + Br- |
| D.定影不能在酸性较强的溶液中进行的原因是:S2O32-+ 2H+=" S↓+" SO2↑+ H2O |
能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是
①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2
④向水中加入明矾晶体 ⑤向水中加NaHCO3固体 ⑥向水中加NaHSO4固体
| A.①②④⑤ | B.①④⑤ | C.③④⑤ | D.④ |
下列实验事实不能证明醋酸是弱酸的是
| A.常温下,测得醋酸钠溶液的pH>7 |
| B.常温下,测得0.1 mol/L醋酸溶液的pH=4 |
| C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4 |
| D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和 |
向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
| A.减小、增大、减小 | B.增大、减小、减小 |
| C.减小、增大、增大 | D.增大、减小、增大 |
现有下列两个图象:下列反应中符合上述图象的是
A.N2(g)+3H2(g) 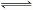 2NH3(g) ΔH<0 2NH3(g) ΔH<0 |
B.2SO3(g) 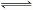 2SO2(g)+O2(g)ΔH>0 2SO2(g)+O2(g)ΔH>0 |
C.4NH3(g)+5O2(g) 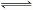 4NO(g)+6H2O(g) ΔH<0 4NO(g)+6H2O(g) ΔH<0 |
D.H2(g)+CO(g) 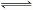 C(s)+H2O(g) ΔH>0 C(s)+H2O(g) ΔH>0 |
对水的电离平衡不产生影响的粒子是
| A.Fe3+ | B.Cl- | C.HCl | D.CH3COO- |