下列实验现象和结论或原因相符的是
| |
操作及现象 |
原因或结论 |
| A |
一块表面打磨过的铝箔在酒精灯上加热至熔化,液态铝不会滴落。 |
铝的熔点高于三氧化二铝 |
| B |
某溶液中加入硝酸银,产生白色沉淀 |
溶液中一定含有Cl- |
| C |
用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 |
溶液中有Na+,无K+ |
| D |
向某溶液中先加KSCN无明显现象,再滴氯水,溶液变红 |
溶液中一定含有Fe2+ |
用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是( )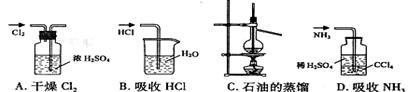
下列关于乙醇和乙酸两种物质的说法不正确的是( )
| A.都能发生取代反应 | B.都能使紫色石蕊试液变红 |
| C.都能发生酯化反应 | D.都能和金属钠反应生成H2 |
某有机物的结构是:关于它的性质的描述正确的是( )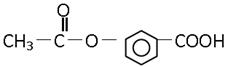
①能发生加成反应;②能溶解于NaOH溶液中;③能水解生成两种有机物;
④不能使溴水褪色;⑤能发生酯化反应;⑥有酸性
| A.①②③ | B.②③⑤ | C.仅⑥ | D.全部正确 |
下列关于有机物的说法中正确的是 ( )
①棉花、蚕丝和人造丝的主要成分都是纤维素
②淀粉、油脂、蛋白质在一定条件下都能发生水解
③有机物完全燃烧后都只能生成二氧化碳和水
④除去乙酸乙酯中残留的乙酸,加过量饱和Na2 CO3溶液振荡后,静置分液
⑤塑料、橡胶和光导纤维都是合成高分子材料
⑥石油的分馏、裂化和煤的干馏都是化学变化
| A.①⑤⑥ | B.②④ | C.①②③⑤ | D.③④⑤⑥ |
下列有关有机化合物的性质和用途的说法正确的是 ( )
| A.乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应 |
| B.乙烯、聚氯乙烯结构中都含有碳碳双键 |
| C.乙醇既可以作燃料,也可以在日常生活中使用,如无水乙醇可用于杀菌、消毒 |
| D.一溴甲烷与1,2—二溴乙烷互为同分异构体 |