下列离子方程式的书写正确的是
| A.氧化亚铁与稀盐酸反应:FeO+2H+=Fe3+ + H2O |
| B.将Na投入到CuSO4溶液:2Na+Cu2+=2Na++Cu |
| C.氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| D.SiO2与NaOH溶液反应:SiO2+2OH-=SiO32-+H2O |
下列有关说法正确的是
| A.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
| B.合成氨的反应是放热反应,则采用低温条件可以提高氨的生成速率 |
| C.常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 |
| D.NH4Cl和HCl溶于水后滴加石蕊都变红色,说明它们均能电离出H+ |
短周期元素原子序数之和为28,X+与Z2-具有相同的核外电子层结构,Y、Z在同一周期。下列推测正确的是
| A.元素Y的最高化合价为+7 |
| B.三种元素的原子半径rZ>rY>rX |
| C.Z的单质比Y的单质更易与H2反应 |
| D.化合物X2Z2中阴阳离子数之比为1: 2 |
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是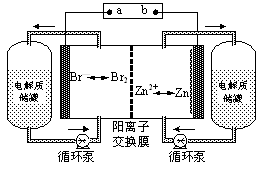
| A.充电时电极a连接电源的负极 |
| B.放电时负极的电极反应式为Zn—2e-=Zn2+ |
| C.放电时左侧电解质储罐中的离子总浓度增大 |
| D.阳离子交换膜可阻止Br2与Zn直接发生反应 |
下列表示对应化学反应的离子方程式正确的是
| A.向铁粉中加入足量稀硝酸:2Fe+6H+=2Fe3++3H2↑ |
| B.向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-=AlO2-+2H2O |
| C.向NaIO3溶液中加入适量NaHSO3溶液:IO3-+3HSO3-=I-+3SO42-+3H+ |
| D.向NH4HCO3溶液中滴加过量NaOH溶液:NH4++HCO3-+2OH-=CO32-+NH3·H2O |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温下,30 g的2-丙醇中含有羟基的数目为0.5 NA |
| B.标准状况下,11.2 L乙炔中含有共用电子对的数目为1.5NA |
| C.1 mol·L-1的碳酸钠溶液中含有CO32-的数目小于NA |
| D.常温下,1 molO2和O3的混合气体中含有氧原子的数目为2.5NA |