设NA为阿伏加德罗常数的值,下列说法正确的是
①在标准状况下,1 mol氦气含有的原子数为NA
②46 gNO2和N2O4的混合物中含有的原子数为3NA
③标准状况下,5.6LCO2与足量Na2O2反应转移的电子数0.5NA
④0.5 mol•L-1 Na2CO3溶液中含有的Na+数目为NA
⑤常温下,当7.1gCl2全部溶于水,反应中转移的电子数等于0.1NA
⑥标准状况下,1L CCl4所含分子数为1/22.4 NA
⑦0.1 molCl2与过量的铁反应转移电子数为0.2 NA
| A.①②③④⑤ | B.①②⑦ | C.②③⑤⑥ | D.①③⑤ |
下列说法不正确的是()
| A.液化石油气(LPG)的主要成份是碳氢化合物 |
| B.光化学烟雾是氮氧化物和烃的排放引发的环境污染 |
| C.CHCl3不存在同分异构体,可以证明甲烷是以碳原子为中心的正四面体结构 |
| D.甲烷与二氧化碳一样,也是一种温室气体 |
最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效1 04倍的超级温室气体“全氟丙烷(C3F8)”,并提出用其“温室化火星”,使其成为第二个地球的计划。有关全氟丙烷说法不正确的是()
04倍的超级温室气体“全氟丙烷(C3F8)”,并提出用其“温室化火星”,使其成为第二个地球的计划。有关全氟丙烷说法不正确的是()
A.C3F8分子中三个碳原子不在同一直线上
B.全氟丙烷的电子式为: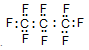
C.相同压强下,沸点:C3F8>C3H8
D.全氟丙烷分子中既有极性键又有非极性键
桶烯(Barrelene)结构简式如右图所示,下列说法不正确的是()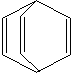
| A.桶烯分子中所有原子在同一平面内 |
B.桶烯一定条件下能发生加成反应和加聚反应 |
| C.桶烯与苯乙烯(C6H5CH=CH2)互为同分异构体 |
| D.桶烯中的一个氢原子被氯原子取代,所得产物只有两种 |
在土卫六上有许多有机化合物和可能潜在的液体环境。尽管它对于生命来说极其寒冷,它类似于地球早期的环境,为此土卫六是最有可能存在生命的星球之一。科学家对探测器发回的数据进行了分析,发现土卫六的大气层中含有95%的氮气,剩余的气体为甲烷和其它碳氢化合物。下列关于碳氢化合物的叙述正确的是()
| A.碳氢化合物的通式为CnH2n+2 | B.石油的主要成分是碳氢化合物 |
| C.乙炔是含碳量最高的碳氢化合物 | D.碳氢化合物中的化学键都是极性键 |
已知A、B为单质,C为化合物。能实现下述转化关系的是()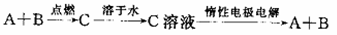
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.②④ C.①③ D.③④