温度为T时,向2.0 L恒容密闭容器中充入2.0 mol NO2,反应2NO2(g) N2O4(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O4(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s |
0 |
50 |
150 |
250 |
350 |
| n(N2O4)/mol |
0 |
0.12 |
0.18 |
0.20 |
0.20 |
下列说法正确的是
A. 反应在前50 s的平均速率为v(NO2)=0.0012 mol·L-1·s-1
B. 保持温度不变,向平衡后的容器中充入1.0 mol N2O4时,v(正)>v(逆)
C. 保持其他条件不变,升高温度达到新平衡时K=0.125,则反应的ΔH<0
D. T温度时,若起始向容器中充入2.0 mol N2O4,则平衡时N2O4的转化率大于80%
在两个容积相同的容器中,一个盛有HCl气体,另一个盛有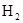 和
和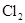 的混合气体.在同温同压下,两容器内的气体一定具有相同的( )
的混合气体.在同温同压下,两容器内的气体一定具有相同的( )
| A.原子数 | B.密度 | C.质量 | D.质子数 |
人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一.氦的该种同位素应表示为( )
A. |
B. |
C. |
D.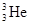 |
国外试行用“汽水”(碳酸饮料)浇灌植物,它的作用是( )
①对植物的呼吸作用有利
②改良碱性土壤,调节pH
③有利于土壤中 ,
, ,被植物吸收
,被植物吸收
④加速光合作用的进行
| A.②③④ | B.②④ | C.② | D.①②③④ |
X,Y,Z三种气体,把a molX和b molY充入一密闭容器中,发生反应:X+2Y 2Z达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )
2Z达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )
A.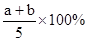 |
B.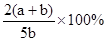 |
C.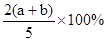 |
D.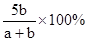 |
已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如下:
1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为a(不考虑醇羟基和硝基与氢氧化钠的反应,下同),溶液蒸干得到的固体产物再与足量的干燥碱石灰共热,又消耗氢氧化钠的物质的量为b,则a,b分别是( )
| A.5mol,10mol | B.6mol,2mol |
| C.8mol,2mol | D.8mol,4mol |