一定温度下,向300 mL 1 mol/L的NaOH溶液中通入b mol CO2,下列说法正确的是
| A.通入CO2过程中溶液的Kw减小 |
| B.当b= 0.2时,所得溶液中部分离子浓度关系为:c (HCO3-) > c (CO32-) > c ( OH-) > c (H+) |
| C.b= 0.3与b= 0.15时,所得溶液中的微粒种类不相同 |
| D.当恰好生成NaHCO3时,溶液中存在:c(Na+)+c(H+)==c(HCO3-)+c( OH-) |
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能
| A.⑤ | B.①③⑤ | C.③⑤ | D.①②④ |
热化学方程式C(s)+H2O(g) CO(g)+H2(g);△H =+131.3kJ/mol表示
CO(g)+H2(g);△H =+131.3kJ/mol表示
| A.碳和水反应吸收131.3kJ能量 |
| B.1mol碳和1mol水反应生成一氧化碳和氢气,并吸收131.3kJ热量 |
| C.1 mol C(S)和1 mol H2O(g)的能量总和大于1mol H2(g)和1mol CO(g)的能量 |
| D.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ |
右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是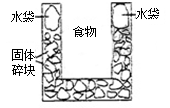
| A.硝酸铵 | B.生石灰 | C.氯化镁 | D.食盐 |
近年来,多地公共汽车大部分采用天然气或燃料电池作为动力,其主要目的是
| A.减少对大气的污染 | B.降低成本 |
| C.防止石油短缺 | D.加大发动机的动力 |
可逆反应:3A(g) 3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小的趋势,则下列判断正确的是
3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小的趋势,则下列判断正确的是
| A.若C为固体,则B一定是气体 | B.B和C一定都是气体 |
| C.B和C可能都是固体 | D.B和C不可能都是气体 |