中国古代的下列发明创造中,不涉及化学变化的是( )
| A.用胆矾炼铜 | B.用铁矿石炼铁 | C.用黏土烧制陶瓷 | D.打磨磁石制指南针 |
“低碳生活”是指生活作息时所耗用能量要减少,从而降低碳(特别是二氧化碳)的排放。下列行为不利于低碳生活的是
| A.用大排量的轿车代替公交车出行 | B.把白炽灯换成节能灯 |
| C.开发太阳能、水能、风能等新能源 | D.自备购物布袋,不用塑料方便袋 |
联合国决定2011年为“国际化学年”,以纪念化学所取得的成就以及对人类文明的贡献为宗旨。下列提法不符合其宗旨的是
| A.化学是一门创造新物质的科学,是自然科学中创造新物质最多的科学领域 |
| B.普及化学知识,宣传化学贡献,提高公众科学素质 |
| C.让公众更多地了解化学为满足社会需求所作出的贡献,鼓励人们尤其是青少年学习化学的兴趣,激发他们创造未来化学的热情 |
| D.推广食用不含任何化学物质的食品 |
向MgSO4和Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2溶液,生成的沉淀与加入Ba(OH)2(aq)
物质的量的关系如左图。读图并参考下表,正确的判断是
| A.OA段可能生成3种沉淀 | B.溶液中Mg2+与AlO2- 不能大量共存 |
| C.由图计算可得n(Mg2+): n(Al3+) = 2:1 | D.BC段与AB段沉淀的种类可能相同 |
根据下表提供的数据可知能大量共存的微粒组是
| 化学式 |
电离常数 |
| CH3COOH |
K=1.7×10-5 |
| HClO |
K=3.0×10-8 |
| H2CO3 |
K1=4.3×10-7 K2=5.6×10-11 |
A.H2CO3、HCO3-、CH3COO-、ClO-
B.HClO、 HCO3-、CH3COO-、ClO-
C.HClO 、HCO3-、ClO-、CO32-
D.HCO3- 、CH3COO-、ClO-、CO32-
叶蝉散(isoprocard)对水稻叶 蝉和飞虱具有较强的触杀作用,且 残毒低。工业上用邻异丙基苯酚合 成叶蝉散的过程如图, 以下推断正确的是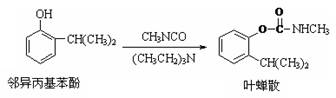
| A.邻异丙基苯酚发生了加成反应 |
| B.邻异丙基苯酚发生了取代反应 |
| C.除去叶蝉散中的邻异丙基苯酚可选用Na2CO3(aq) |
| D.叶蝉散中是否含邻异丙基苯酚可用少量稀溴水检验 |