已知: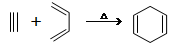 ,如果要合成
,如果要合成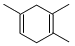 所用的原始原料可以是( )
所用的原始原料可以是( )
①2-甲基-l,3-丁二烯和2-丁炔 ②1, 3-戊二烯和2-丁炔
③2, 3-二甲基-1, 3-戊二烯和乙炔 ④2, 3-二甲基-l, 3-丁二烯和丙炔
| A.②③ | B.①④ | C.②④ | D.只有① |
下列有关说法正确的是
| A.常温下,0.1 mol/L NH4Cl溶液加蒸馏水稀释,溶液的pH不断增大,但无限接近7 |
| B.25 ℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
| C.pH=6的纯水中,c(OH-)=10-8 mol·L-1 |
| D.稀释0.01 mol·L-1的醋酸溶液时,溶液中所有的离子浓度均减小 |
一定温度下,水存在H2O H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是
H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是
| A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 |
| B.将水加热,Kw增大,pH减小 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.向水中加入少量固体硫酸钠,c(H+)=10-7 mol·L-1,Kw不变 |
不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示。下列有关说法中正确的是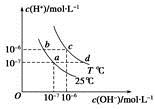
| A.若从a点到c点,可采用在水中加入酸的方法 |
| B.b点对应的醋酸中由水电离的c(H+)=10-6mol·L-1 |
| C.c点对应溶液的Kw大于d点对应溶液的Kw |
| D.T ℃时,0.05 mol·L-1的Ba(OH)2溶液的pH=11 |
下列有关电解质溶液的说法正确的是
| A.在蒸馏水中滴加浓H2SO4,KW不变 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是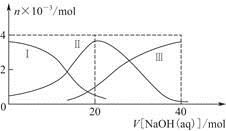
| A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.H2A第一步电离的方程式为H2A=HA-+H+ |
| D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |