向2 L的密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图甲所示。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且4个阶段所改变的外界条件均不相同,已知t3——t4阶段为使用催化剂。观察下图,回答下列问题:

(1)甲图中从反应至达到平衡状态,生成物C的平均反应速率为 。
(2)乙图中t2时引起平衡移动的条件是 ,t5时引起平衡移动的条件是 。
(3)乙图中表示平衡混合物中,在这4个阶段中C的含量最高的一段时间是 。
(4)该反应的化学方程式可以表示为: ,正反应为 (填“放热”或“吸热”)反应。
(5)反应开始时加入的B的物质的量为 。
芬必得是一种解热、镇痛及抗生素类药物的商品名,其主要成分是化合物对异丁基-α-甲基苯乙酸,药名为布洛芬,它有多种合成路线,下面是一种合成方法: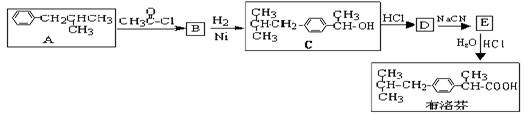
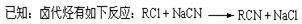 ,
,
回答下列问题:
(1)写出有机物B、D的结构简式:BD
(2)写出反应类型:A→BB→C
(3)有机物C和苯酚的关系是(填选项字母)
A 、互为同分异构体 B、互为同系物
C、均属于芳香族化合物D、均属于芳香醇类
(4)根据布洛芬结构,下列判断不正确的是(填选项字母)
A、芳香族化合物 B、苯甲酸的同系物
C、能与溴水发生加成反应而使溴水褪色 D、能使酸性高锰酸钾溶液褪色
(5)与A具有相同分子式,且苯环上只有一个取代基的有机物共有四种,写出除A外的其余三种的结构简式:,,
(6)写出由E生成布洛芬的化学方程式:
有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阳离子和一种阴离子且互不重复)
| 阳离子 |
K+、Na+、Ba2+、NH4+ |
| 阴离子 |
CH3COO—、Cl—、OH—、SO42— |
已知:①A、C溶液的pH均大于7,B溶液的pH小于7,A、B的溶液中水的电离程度相同;D溶液焰色反应显黄色。
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A的名称是
(2)写出C溶液和D溶液反应的化学方程式
(3)25℃时pH=9的A 溶液和pH=9的C溶液中水的电离程度小的是 (填写A或C的化学式)
(4)25℃时用惰性电极电解D的水溶液,一段时间后溶液的pH 7;(填>、< 或=)
(5)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为
(6)室温时在一定体积0.2mol·L—1的C溶液中,加入一定体积的0.1mol·L—1的盐酸时,混合溶液的pH=13,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是
某学生利用物质间的互变,设计成一个平面魔方,如下图所示:
已知①A、B、C、D、G含有同种元素。
②E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。B具有氧化性,能将SO2氧化为F(H2SO4),F与A反应生成E、G。
| 纯A(单质) |
B溶液 |
C固体 |
D固体 |
G溶液 |
|
| 颜色 |
银白色 |
黄色 |
红褐色 |
红棕色 |
浅绿色 |
③
依据以上信息填空:
(1)请写出E的电子式 、D的化学式。
(2) 请指出A、B、C、D、G所含的同种元素在周期表中的位置第周期第族,
(3)G生成C的过程中所出现的现象为
(4)写出下列反应的化学方程式:
E→A A→B
(5)B→F的离子方程式为
请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 。在GaN晶体中,每个Ga原子与 个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为 。在四大晶体类型中,GaN属于 晶体。
(3)在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,请推测
NCl3水解的主要产物是 (填化学式)。
(10分)以下一些氧化物和单质之间可以发生如下图所示的反应:
其中,氧化物(I)是红棕色固体,氧化物(II)、(III)、(IV)在反应条件下都是气体。
(1)氧化物(I)的化学式(分子式)是。
氧化物(II)的化学式(分子式)是。
(2)反应①的化学方程式是。
反应②的化学方程式是
反应③的化学方程式是