已知硫酸在水中的电离方程式是:H2SO4 = H+ + HSO4— HSO4— H++SO42—,回答下列问题:
H++SO42—,回答下列问题:
(1)Na2SO4溶液显 (填“酸性”,“中性”或“碱性”)。理由是(用离子方程式表示) 。
(2)在0.1 mol·L-1的Na2SO4溶液中,下列微粒浓度关系正确的有 。
| A.c(SO42—)+c(HSO4—)+c(H2SO4)="0.1" mol·L-1 |
| B.c(OH-)=c(H+)+c(HSO4—) |
| C.c(Na+)+c(H+)=c(OH-)+c(HSO4—)+2c(SO42—) |
| D.c(Na+)=2c(SO42—)+2c(HSO4—) |
(3)如果25 ℃时,0.1 mol·L-1的NaHSO4溶液中c(SO42—)="0.029" mol·L-1,则0.1 mol·L-1H2SO4溶液中c(SO42—) 0.029 mol·L-1(填“<”,“>”或“=”),理由是 。
(4)0.1 mol·L-1NaHSO4溶液中各种离子浓度由大到小的顺序是: 。
(5)如果25 ℃时,0.10 mol·L-1H2SO4溶液的pH="-lg" 0.11, 则25 ℃时,0.10 mol·L-1的H2SO4溶液中c(SO42—)= 。
.(10分)标准状况下,含有相同氧原子数的CO和CO2,其物质的量比为;质量之比为;碳原子数比为;原子数比为;体积之比为________________。
某双原子分子构成的气体,其摩尔质量为M (g·mol-1),已知阿伏加德罗常数为NA (mol-1),标准状况下气体摩尔体积为Vm (L·mol-1),现有质量为n g的该气体,则:
(1) 该气体的物质的量为mol。
(2) 该气体在标准状况下的体积为L。
(3) 该气体所含原子总数为个。
(9分)根据右图物质之间的转化关系,回答: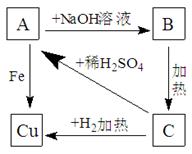
(1)写出A、B、C的化学式:
A___________;B___________;C___________。
(2)写出下列各步的化学反应方程式:
A→B:_____________________________________;
A→Cu:____________________________________。
B→C:_____________________________________。
(12分)现有下列9种物质:碳酸钠、氧化铁、二氧化硫、铜、氯气、氢氧化钾、硫酸、一氧化碳、硝酸铝,请将上述物质按要求完成下列问题:
(1)用相应化学式填写下列空白:
属于酸性氧化物的有_____________,属于碱性氧化物的有_____________,
属于盐的有__________________________________。(用相应化学式填空)
(2)按要求完成下列方程式:
① 盐与酸反应_________________________________,
② 氧化物与碱反应_________________________________,
③ 属于氧化还原反应的化合反应_______________________________,
④ 不属于四种基本反应类型的氧化还原反应_______________________________。
将10.6克Na2CO3溶于水制成2L溶液,该溶液中的物质的量浓度为____________mol/L,溶液中Na+ 的物质的量浓度是__________mol/L