某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。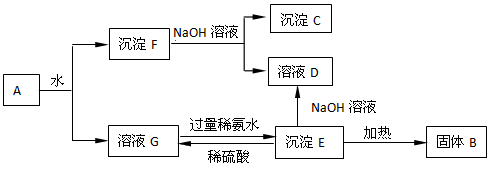
请回答下列问题。
(1)图中涉及分离溶液与沉淀的方法是_______________。
(2)写出以下4种物质的化学式为:B_________、C_________、D_________、E_________。
(3)沉淀F与NaOH溶液反应的离子方程式为__________________。
沉淀E与稀硫酸反应的离子方程式为__________________。
溶液G与过量稀氨水反应的化学方程式为_________________________。
Ⅰ.某废水中可能含有下列离子中的若干种:Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-。现进行如下实验:
a.取少量溶液,加入KSCN溶液,无明显变化
b.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色
c.向b中所得溶液中加入BaCl2溶液,有白色沉淀生成
d.向b中所得溶液中加入过量浓氨水,仅有红褪色沉淀生成,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成
(已知Cu2+与过量浓氨水反应生成四氨合铜离子)请回答下列问题:
(1)该废水一定含有的离子是_____________;
(2)实验b中加入盐酸生成无色气体的离子方程式是________________;
(3)过滤除去d中的蓝色沉淀,调整溶液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为Al+NO3-+OH- AlO2-+NH3+N2+H2O(未配平)。若除去0.2molNO3-,消耗铝___g。
AlO2-+NH3+N2+H2O(未配平)。若除去0.2molNO3-,消耗铝___g。
Ⅱ.某混合液中,可能大量含有的离子如下表:
| 阳离子 |
H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 |
Cl-、Br-、OH-、CO32-、AlO2- |
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示:
(1)该溶液中一定含有的阳离子是_____________,溶液中一定不存在的阴离子是________。
(2)请写出沉淀减少的离子方程式________________________。
化合物A的分子式为C9H15OCl,分子中含有一个六元环和一个甲基,环上只有一个取代基;F分子中不含甲基:A与其它物质之间的转化如下图所示: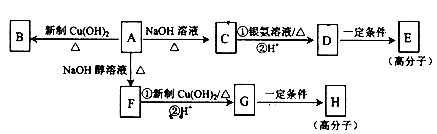
(1) A-F的反应类型是________________;G中含氧官能团的名称是____________。
(2)A-C的反应方程式是____________________。
(3)H的结构简式是____________________,E的结构简式是____________。
(4)有的同学认为B中可能没有氯原子,你的观点是________________(填“同意”或“不同意”)你的理由_______________。
(5)某烃的含氧衍生物X符合下列条件的同分异构体中,核磁共振氢谱显示为2组峰的是_____________(写结构简式);只含有两个甲基的同分异构体有____________种。
①相对分子质量比C少54;②氧原子数与C相同 ; ③能发生水解反应。
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(0H)n(S04)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
请回答下列问题:
(1)若A为H20(g),可以得到Fe304,写出其转化的化学方程式: 。
(2)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸钾的化学方程式 并配平:
(3)为测定溶液Ⅰ中铁元素的总含量,实验操作:准确量取20.00mL溶液Ⅰ于带塞锥形瓶中,加入足量H202,调节pH<3,加热除去过量H202;加入过量KI充分反应后,再用 O.1OOOmol.L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I-=2Fe2++I2 I2+2S2O32-=2I-+S4O62-
①写出滴定选用的指示剂 ,滴定终点观察到的现象 。
②溶液Ⅰ中铁元素的总含量为 g.L-1。若滴定前溶液中H202没有除尽,所测定的铁元素的含量将会 (填“偏高”“偏低”“不变”)。
(4)将3.48gFe3O4完全溶解在100mL 1 mol·L-1H2SO4溶液中,然后加入K2Cr2O7溶液25mL,恰好使溶液中的Fe2+全部反应,Cr2O72-转化为Cr3+。则K2Cr2O7溶液的物质的量浓度为
Ⅰ、A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA2、BA3两种化合物。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。请回答下列问题:
①D元素在元素周期表中的位置是______________。
②A与D所形成的化合物的电子式为___________________。
③将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的化学方程式为_______________ 。
Ⅱ、由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图转化关系(部分生成物和反应条件已略去)。
(1)若A为金属钠, A与水反应的离子方程式为 。
(2)若A为过氧化钠, A与水反应的化学方程式为 。
(3)A不论是Na还是Na2O2,依据转化关系判断物质D是 ,
(4)向30ml某浓度的B溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示两种情况(不计CO2的溶解),则曲线B表明M中的溶质为 ;原NaOH溶液的物质的量浓度为 ;由曲线A、B可知,两次实验通入的CO2的体积比为 。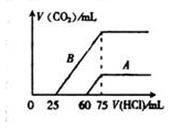
(5)请你设计一实验证明Na2CO3溶液碱性比NaHCO3溶液的碱性强:__________________。
有机物A是一种纯净的无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A物质 18.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为_______。 |
(2)A的核磁共振氢谱如图: |
(2)A中含有________种氢原子。 |
| (3)另取A 18.0 g与足量的NaHCO3粉末反应,生成0.2 mol CO2,若与足量钠反应则生成0.2 mol H2。 |
(3)写出一个A分子中所含官能团的名称和数量_____________。 |
| (4)将此18.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者依次增重10.8 g和26.4 g。 |
(4)A的分子式为________。 |
| (5)综上所述A的结构简式_____________________________。 |