某溶液中可能含有下列6种离子中的某几种:Cl—、SO42—、CO32—、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
| A.一定存在SO42—、CO32—、NH4+,可能存在Cl—、Na+、K+ |
| B.一定存在Cl—、SO42—、CO32—、NH4+,一定不存在Na+、K+ |
| C.c(CO32—)=0.01mol·L-1,NH4+>SO42— |
| D.如果上述6种离子都存在,则c(Cl—)>c(SO42—) |
一定温度下,把2. 0体积的N2和6. 0体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2
 2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是
2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是
| A.1.0体积的N2和3.0体积的H2 |
| B.2.0体积的N2、6.0体积的H2和4.0体积的NH3 |
| C.4.0体积的NH3和1.0体积的H2 |
| D.2.0体积的NH3 |
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g) 4NO2(g)+O2(g)ΔH > 0
4NO2(g)+O2(g)ΔH > 0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s |
0 |
500 |
1000 |
1500 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法中不正确的是
A.500 s内N2O5分解速率为2.96×10-3 mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再平衡时c(N2O5)>5.00 mol·L-1
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/(mol·L-1) |
0.1 |
0.2 |
0 |
| 平衡浓度/(mol·L-1) |
0.05 |
0.05 |
0.1 |
下列说法错误的
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1 600
2Z,其平衡常数为1 600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
在不同温度下,向2 L密闭容器中加入1 mol NO和1 mol活性炭,发生反应:
2NO(g)+C(s)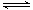 N2(g)+CO2(g) ΔH=﹣213.5 kJ/mol,达到平衡时的数据如下:
N2(g)+CO2(g) ΔH=﹣213.5 kJ/mol,达到平衡时的数据如下:
| 温度/℃ |
n(活性炭)/mol |
n(CO2)/mol |
| T1 |
0. 70 |
_______ |
| T2 |
_______ |
0.25 |
下列说法不正确的是
A.上述信息可推知:T1<T2
B.T1℃时,该反应的平衡常数K=9/16
C.T2℃时,若反应达平衡后再缩小容器的体积,c (N2) :c (NO)不变
D.T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
向某恒容密闭容器中充入一定量C02和H2:,发生反应: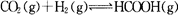 测得平衡体系中C02的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是
测得平衡体系中C02的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是
①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数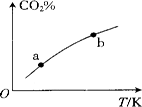
| A.①② | B.①③ | C.②④ | D.③④ |