X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时, X和W可形成化合物,该化合物0.1mol/L的水溶液pH为1,下列说法正确的是 ( )
| A.Z、R、W形成的单核离子核外电子数相等 |
| B.R元素的最高价氧化物的水化物酸性最强 |
| C.原子半径:X<Y<Z<R<W |
| D.X、Z分别与Y可形成原子个数比为1:1或2:1的化合物 |
在一定条件下, 与足量的
与足量的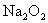 固体完全反应后,产生的气体全部收集起来只有1.68L(标准状况),则此气体在标准状况下的密度为()
固体完全反应后,产生的气体全部收集起来只有1.68L(标准状况),则此气体在标准状况下的密度为()
A. |
B.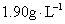 |
C. |
D. |
X、Y是除第一周期外的短周期元素,它们可以形成离子化合物XmYn,且离子均具有稀有气体原子的结构,若X的原子序数为a,则Y 的核电荷数不可能是:
| A.a+8-m-n | B.a+16-m-n | C.a-m-n | D.a-8+m+n |
下列合金抗腐蚀性能较好的是( )
| A.铝合金 | B.青铜 | C.碳素钢 | D.生铁 |
某种钢铁材料含碳为2.4%,这种材料是()
| A.生铁 | B.特种钢 | C.碳素钢 | D.高碳钢 |
合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。分析下表中的数据,不能形成合金的是
| Na |
Cu |
Al |
Fe |
|
| 熔点/℃ |
97.8 |
1083 |
660 |
1535 |
| 沸点/℃ |
883 |
2567 |
2467 |
2750 |
A.Cu和Al B.Fe和Cu C.Cu和Na D.Al和Na