常温下,下列溶液中各微粒的物质的量浓度关系正确的是( )
| A.浓度为0.1 mol/L CH3COOH与0.1 mol/L CH3COONa混合后溶液呈弱酸性,则c(CH3COOH>c(Na+)>c(CH3COO-) |
| B.相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ |
| C.NaHCO3溶液:c(OH-)-c(H+)=c((HCO3-)+2c(H2CO3) |
| D.等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO) + c(ClO-)= c(HCO3-) + c(H2CO3) + c(CO32-) |
2005年11月13日中国石油吉林石化公司双苯厂发生爆炸事故,大量硝基苯泄漏,引起松花江水污染,安全生产和环保问题再次引起人们的关注.下列关于硝基苯的叙述正确的是()
| A.硝基苯是一种油状物质,会浮在水面上 |
| B.实验室制硝基苯需要用水浴加热 |
| C.硝基苯中毒是由蒸气吸入或误食引起的,与皮肤接触不会引起中毒 |
| D.硝基苯是由苯酚和硝酸直接反应生成的 |
下面是某些稠环芳烃的结构简式()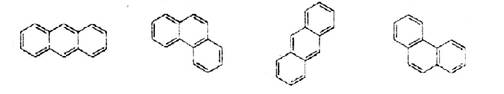
试分析这些式子所表示的化合物种类为()
| A.1种 | B.2种 | C.3种 | D.4种 |
已知1,2,3-三苯基环丙烷的3个苯基可分布在环丙烷环平面的上下,因此有如下2个异构体。
 |
据此,可判断1,2,3,4,5-五氯环戊烷的异构体数是()
| A.4 | B.5 | C.6 | D.7 |
间-二甲苯苯环上的三溴代物的同分异构体数目为()
| A.1 | B.2 | C.3 | D.4 |
可用来鉴别乙烯、四氯化碳、苯的方法是()
| A.酸性高锰酸钾 | B.溴水 | C.液溴 | D.硝化反应 |