常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是
| A.三种酸的电离常数:Ki1(H2CO3) > Ki(HX) > Ki(HY) > Ki2(H2CO3) |
| B.NaX溶液中通入足量CO2后的离子浓度:c(HCO3-)>c(CO32-)>c(X-) |
| C.同浓度溶液的碱性:NaX > Na2CO3 > NaY > NaHCO3 |
| D.结合H+的能力:Y- > CO32- > X- > HCO3- |
关于维生素的叙述中,不正确的( )
| A.维生素是参与生物发育和新陈代谢所必需的一类小分子 |
| B.维生素在天然食品中含量丰富,所以加工后的食品维生素含量也高 |
| C.人体对维生素的需要量极小,但对人体的生长和健康至关重要 |
| D.习惯上把维生素分为脂溶性维生素和水溶性维生素 |
下列叙述正确的是( )
A.目前加碘食盐主要添加的是KIO3 |
| B.日常生活中无水乙醇常用于杀菌消毒 |
| C.绿色食品是不含任何化学物质的食品 |
| D.在空气质量日报中CO2含量属于空气污染指数 |
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制备: 2KClO3+H2C2O4+H2SO4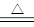 2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是()
2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是()









| A.H2C2O4在反应中被氧化 | B.KClO3在反应中得到电子 |
| C.CO2是还原产物 | D.4 molKClO3参加反应有8 mol电子转移 |
对于某些离子的检验及结论一定正确的是()
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32—[来源 |
B.加入氯化 钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42— 钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42— |
| C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| D.某物质灼烧时,焰色反应为黄色,则该物质一定是钠的化合物 |
下图是一种试验某种气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶盛的溶液是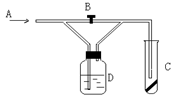
| A.浓硫酸 | B.饱和食盐水 |
| C.浓氢氧化钠溶液 | D.氢氧化钙悬浊液 |