某温度下水的离子积常数为KW,该温度下,将a mol/L的一元酸HA与b mol/L一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,c(H+)=  mol/L mol/L |
| D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) |
下列化合物中,既有离子键,又有共价键的是()
| A.CaO | B.SiO2 | C.H2O | D.Na2O2 |
下图是一个电化学过程的示意图。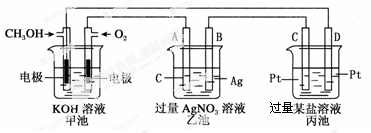
请回答下列问题:
(1)图中甲池是________(填“原电池”“电解池”或“电镀池”)。
(2)A(石墨)电极的名称是________(填“正极”“负极”“阴极”或“阳极”)。
(3)写出通入CH3OH的电极的电极反应式:_____________。
(4)乙池中反应的化学方程式为________,当乙池中B(Ag)极质量增加5.4 g,甲池中理论上消耗O2的体积为________L(标准状况),此时丙池中某电极析出1.6 g某金属,则丙池中的某盐溶液可能是________。
| A.MgSO4 | B.CuSO4 | C.Pb(NO3)2 | D.AgNO3 |
恒压下,在-个可变容积的密闭容器中发生如下反应:2SO2(g)+ O2(g)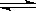 2SO3(g);若开始时放入2mol SO2和1mol O2,达平衡后,生成amol SO3;若开始时放入xmol SO2、2mol O2和2mol SO3,达平衡后,SO3的物质的量是3a mol,则x为
2SO3(g);若开始时放入2mol SO2和1mol O2,达平衡后,生成amol SO3;若开始时放入xmol SO2、2mol O2和2mol SO3,达平衡后,SO3的物质的量是3a mol,则x为
| A.1mol | B.2mol | C.3mol | D.4mol |
氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是 H2+2NiO(OH) 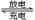 2Ni(OH)2。下列叙述正确的是
2Ni(OH)2。下列叙述正确的是
| A.电池放电时,电池负极周围溶液的pH不断增大 |
| B.电解质溶液可以是稀硫酸 |
| C.外电路中每通过0.2mol电子,H2的质量理论上减小0.2g |
| D.电池工作时,电子由正极通过外电路流向负极 |
室温下,取浓度相同的NaOH溶液和HCl溶液,以体积比3:2相混合,所得溶液的pH=12,则原溶液的浓度为
| A.0.01mol/L | B.0.017mol/L | C.0.05mol/L | D.0.50mol/L |