海水开发利用的部分过程如图所示。下列说法错误的是
| A.向苦卤中通入Cl2是为了提取溴 |
| B.粗盐可采用除杂和重结晶等过程提纯 |
| C.工业生产中常选用NaOH作为沉淀剂 |
| D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O  Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是
Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是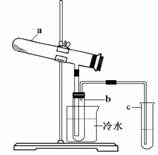
| A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4 |
| B.b中产物用紫色石蕊试液即可检验出其中H+和SO42— |
| C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液 |
| D.b中所得到的硫酸的质量分数为29.5% |
四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种流体的水槽中,发生的现象如下图所示,其中充满Cl2的试管是()
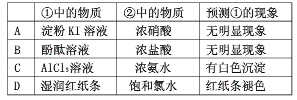
用如下图所示装置进行下列实验,实验结果与预测的现象不一致的是
| ①中的物质 |
②中的物质 |
预测①的现象 |
|
| A |
淀粉KI溶液 |
浓硝酸 |
无明显现象 |
| B |
酚酞溶液 |
浓盐酸 |
无明显现象 |
| C |
AlCl3溶液 |
浓氨水 |
有白色沉淀 |
| D |
湿润红纸条 |
饱和氯水 |
红纸条褪色 |
下列有关物质检验的实验结论正确的是 ( )
| 选项 |
实验操作及现象 |
实验结论 |
| A |
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO |
| B |
向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 |
该溶液中一定含有Fe2+ |
| C |
将某气体通入品红溶液中,品红溶液褪色 |
该气体一定是SO2 |
| D |
将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成 |
该物质一定属于醛类 |
下列实验操作使测定(或配制)结果偏低的是()
| A.测量一包固体的质量,将药品放在右盘,砝码放在左盘 |
| B.中和滴定用的锥形瓶加入少量待测液润洗后,再加待测液 |
| C.在保温容器中测量NaOH和稀盐酸反应的中和热时加入稍过量的NaOH溶液 |
| D.配制一定物质的量浓度的溶液,定容时仰视刻度线 |