某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子。向该溶液中逐滴加入一定物质的量浓度的盐酸溶液里,发现生成沉淀的物质的量随盐酸溶液的体积变化如图所示。下列说法正确的是
| A.原溶液中一定含有Na2SO4 |
| B.反应最后形成的溶液中的溶质只有NaCl |
| C.原溶液中一定含有的阴离子是:OH-、CO32-、SiO32-、AlO2- |
| D.原溶液中含有CO32-与AlO2-的物质的量之比为1:2 |
化学在日常生活中有着重要的应用,下列说法中正确的是
| A.地沟油的主要成分是高级脂肪酸甘油酯,可用于制肥皂和加工食用油。 |
| B.棉、麻、丝、毛及合成纤维完全燃烧都只生成C02和H20,对环境不会有影响 |
| C.BaSO4在医学上用作钡餐,Ba2+对人体无毒 |
| D.“落汤螃蟹着红袍”肯定发生了化学变化 |
下列叙述正确的是
| A.红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟,加少量的水形成绿色溶液 |
| B.检验氨气的方法是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈红色 |
| C.在淀粉溶液中加入稀硫酸并加热数分钟,冷却后依次加入新制Cu(OH)2悬浊液和碘水可检验淀粉是否已发生水解和是否完全水解 |
| D.铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色溶液 |
下列说法不正确的是
| A.乙烯、乙醇均能使酸性高锰酸钾溶液褪色 |
| B.通过乙烷的取代反应或乙烯的加成反应都可以制取纯净的氯乙烷 |
| C.淀粉、纤维素都属于糖类,它们通式相同,但它们不互为同分异构体 |
D.1mol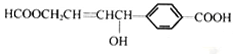 可与2molNaOH反应 可与2molNaOH反应 |
下面说法中正确的是
A.标有“ ”的包装材料可以用来包装食品 ”的包装材料可以用来包装食品 |
| B.酒精消毒原理是将病毒彻底氧化 |
| C.GaN中的氮和镓均属于第IIIA族元素 |
| D.麦芽糖的水解产物能发生银镜反应 |
下列关于有机物的说法正确的是
| A.涤纶、纤维素、酚醛树脂都是合成材料 |
| B.汽油和植物油都是混合物,主要成份是烃和酯 |
| C.甲酸与乙酸是有机酸,都不能被酸性高锰酸钾溶液氧化 |
| D.葡萄糖、蔗糖、淀粉在一定条件下都可发生水解反应 |