危化仓库中往往存有钠、钾、硫、白磷(P4)、硝酸铵和氰化钠(NaCN)等危险品。请回答下列问题:
(1)NH4NO3为爆炸物,在某温度下按下式进行分解:5NH4NO3 =4N2 ↑+ 2HNO3 + 9H2O
则被氧化和被还原的氮元素质量之比为_____________;
(2)硫酸铜溶液是白磷引起中毒的一种解毒剂:1lP4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为______________mol;
(3)NaCN属于剧毒物质,有一种处理方法其原理为:CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色弱电解质,另一种与H+作用产生能使品红溶液腿色的刺激性气体,写出离子反应方程式:_________________________________。
(5分)已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水 平②2CH3CHO+O2
平②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成E,E是一种有香味的有机物,其合成路
2CH3COOH。现以A为主要原料合成E,E是一种有香味的有机物,其合成路 线如下图所示。
线如下图所示。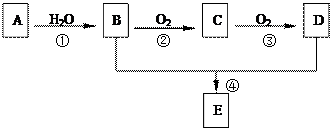
回答下列问题:
(1)B、E分子中的官能团名称分别是、。
(2)写出下列反应的反应类型:④。
(3)写出反应②的化学方程式:。
I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是腐蚀(填“析氢”或“吸氧”)。
(2)写出铁锅腐蚀正极的电极反应式:
II.美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。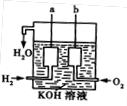
(1)a是__________极;电极反应式为___________________。
(2)已知: ;
;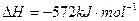 ,
,
飞船上宇航员的生活用水由燃料电池提供。已知这种电池发1度电(3600KJ)时能生成360g水,则该电池的能量的利用率为________.
在如图所示的三个容积相同的三个容器①、②、③中进行如下的反应:
3A(g) + B(g) 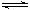 2C(g);△H<0
2C(g);△H<0
(1)若起始温度相同,分别向三个容器中充入3 mol A和1 mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为(填容器编号);
(2)若维持温度不变,起始时② 、③中均投入3 mol A、1 mol B,则达到平衡时,两容器中C物质的物质的量浓度②③(填<、>、=);
、③中均投入3 mol A、1 mol B,则达到平衡时,两容器中C物质的物质的量浓度②③(填<、>、=);
(3)在②中投入3 mol A和1 mol B达平衡;若在相同条件下,起始时在②中投入a mol A和b mol B及c mol C,使两种情况达平衡时容器内C的百分含量相等,则a、b、c的关系为。
(1)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在些过程中,溶液的碳酸氢根离子浓度变化趋势可能是:
| A.逐渐减少 | B.逐渐增大 | C.先逐渐增大,而后减小 | D.先逐渐减小,而后增大 |
你的选择是________。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Ag+ Na+ |
| 阴离子 |
NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、c三种溶液,电极均为石墨电极。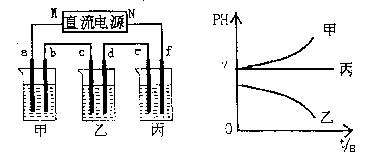
接通电源,经过一端时 间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的:极(填写“正”或“负”) ,甲、乙电解质分别为、(填写化学式)。
,甲、乙电解质分别为、(填写化学式)。
(2)写出d电极上发生反应的电极反应式.
(3)若电解后甲溶液的体积为 25L,且产生的气体全部逸出则该溶液常温时的pH为。
25L,且产生的气体全部逸出则该溶液常温时的pH为。
(4)若丙装置产生的两种气体与氢氧化钠溶液、铂电极形成燃料电池,请写出正极的电极反应式:.
(5)要使电解后丙中溶液恢复到原来的状态,应加入物质。(填写化学式)