A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。

请回答下列问题:
(1)A物质的名称为________________;
(2)C与D在高温下的反应在冶金工业上称为 反应,C与D反应的化学方程式: 。
(3)写出G→J的化学方程式:___ ;
写出J→D的化学方程式: ;
(4)A→H的离子方程式为_____________________________;
(5)用离子方程式表示I物质能用于净水的原理___________ _。
A、B两种液态有机物均由碳、氢、氧三种元素组成,物质A能溶于水,它的相对分子质量是60,分子中有8个原子,其中氧原子数与碳原子数相等,且A与Na2CO3溶液混合时冒气泡。B分子中有9个原子,分子内所有原子的核电荷数之和为26,且B只能跟钠反应放出氢气,不能与Na2CO3溶液反应。请填空:
(1)A的结构简式为 ,B的结构简式为 。
(2)写出B与Na反应的化学方程式 。
(3)写出A与B反应的化学方程式 。
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。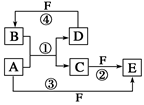
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为________,反应④的化学方程式为______________________________________________。
若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,其离子方程式是____________________________________________,
写出反应④的化学方程式:____________________。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为_____________________________________________。
下表为元素周期表的片段组合,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
 族 族周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)⑤、⑥、⑧相应离子半径最大的是(离子符号表示)________ ,②、③、⑥的最高价氧化物的水化物酸性最强的是[填化学式] ________, ②、④、⑤元素可形成既含离子键又含共价键的一种可溶于水的化合物,其化学式为________。
(2)现有Z、W两种中学化学中的常见物质,Z由①、③、④中三种元素组成。Z的浓溶液常温下能使铁钝化,W中①、③两种元素组成且质量比为3:14,写出W与Z反应的化学方程式。
(3)电动汽车的某种燃料电池,通常用⑤的最高价氧化物对应的水化物作电解质,用⑥的单质、石墨作电极,在石墨电极一侧通入空气,该电池负极的电极反应 。
B、C、D、E均是短周期元素。B元素原子最外层上的电子数为内层电子总数的2倍。B元素原子和C元素原子最外层电子数之差为2。C和D形成的化合物进行焰色反应火焰呈黄色。E元素的气态单质、E的最高价氧化物的水化物均能与D的最高价氧化物的水化物反应。
(1)上述4种元素按照原子序数由大到小排列为____、____、____、____;(填元素符号);
(2) B、C形成的化合物(比空气重)的结构式为;
(3)C、D的单质在加热条件下生成物质X,其中含有化学键的类型为_____;X的电子式为;
(4)Y是C的气态氢化物。常温下,将D的单质投入Y中,发生反应的离子方程式为__________________;该反应__________(填“能”、“不能”)作为设计原电池的反应原理。
下图是元素周期表的框架,请在表中①~⑩元素中回答问题
| ① |
|||||||||||||||||
| ② |
③ |
④ |
|||||||||||||||
| ⑤ |
⑥ |
⑦ |
⑧ |
||||||||||||||
| ⑨ |
⑩ |
||||||||||||||||
请用化学语言回答下列问题:
(1)在表中④、⑤、⑥三种元素的简单离子半径由大到小的顺序为__________________________。
(2)其中⑤与⑦两元素的最高价氧化物的水化物反应的离子方程式为_______________________。
(3)⑧与⑩两种元素非金属较强的是________,请用一个离子方程式证明该结论_________。
(4)①与③的两种单质可以在金属铂做电极时构成一种对环境友好的燃料电池,电解质为⑨的最高价氧化物的水化物,请书写出正极反应式_____________________,电池工作时阴离子定向移动到________极(填正或负)。
(5)元素①与⑧的两种单质在一定条件下可反应生成一种化合物甲,已知下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ),则生成1mol甲时释放的能量为____________kJ。
| 化学键 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
| 能量(kJ) |
243 |
193 |
151 |
432 |
366 |
298 |
436 |