下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A.在0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B.在0.1mol•L-1Na2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3) |
| C.向0.2 mol•L-1NaHCO3溶液中加入等体积0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1mol•L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
[双选题]为了避免青铜器生成铜绿,以下方法正确的是( )
| A.将青铜器放在银质托盘上 |
| B.将青铜器保存在干燥的环境中 |
| C.将青铜器保存在潮湿的空气中 |
| D.在青铜器的表面覆盖一层防渗透的高分子膜 |
21世纪是钛的世纪。在800℃~1 000℃时电解TiO2可制得钛,装置如图所示。下列叙述正确的是( )
| A.a为电源的正极 |
| B.石墨电极上发生还原反应 |
| C.阴极发生的反应为:TiO2+4e-=Ti+2O2- |
| D.每生成0.1 mol钛,转移电子0.2 mol |
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
| A.每生成2分子AB吸收b kJ热量 |
| B.该反应热ΔH=+(a-b)kJ·mol-1 |
| C.该反应中反应物的总能量高于生成物的总能量 |
| D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量 |
沼气是一种能源,它的主要成分是CH4,0.5 mol CH4完全燃烧生成CO2和H2O(l)时,放出445 kJ热量,则下列热化学方程式中正确的是( )
| A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)ΔH=+890 kJ/mol |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=+890 kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890 kJ/mol |
D.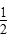 CH4(g)+O2(g)= CH4(g)+O2(g)=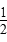 CO2(g)+H2O(l)ΔH=-890 kJ/mol CO2(g)+H2O(l)ΔH=-890 kJ/mol |
为了测定中和反应的反应热,计算时至少需要的数据是( )
①酸的浓度和体积 ②碱的浓度和体积 ③比热容④反应后溶液的质量
⑤生成水的物质的量 ⑥反应前后溶液温度变化 ⑦操作所需的时间
| A.①②③⑥ | B.①③④⑥ |
| C.③④⑤⑥ | D.全部 |