下图为教材中测定中和热的简易量热计。
(1)图中尚缺少的玻璃仪器是_____________,实验中若用金属质地的仪器来代替会使得的△H___(填“偏高”、“偏低”或“无影响”)。
(2)如果用50mL0.50mol/L的盐酸和50mL0.55mol/L的氢氧化钠溶液进行实验,已知二者的密度均为1g/cm3,比热容c=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃,则中和热△H为______kJ/mol,实验中氢氧化钠溶液比盐酸浓度大的原因是____________________。
肼(N2H4)是火箭发射常用的燃料。
(1)最新实验研究用肼还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。请写出该制法的化学反应方程式____________________________,当反应中转移0.2 mol电子时,可制得Cu2O的质量为__________。
(2)一种以肼(N2H4)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。负极上发生的电极反应为_________________; ②电池工作时产生的电流从_______电极经过负载后流向________电极(填“左侧”或“右侧”)。
氮有多种氧化物,其中N2O5是一种新型硝化剂,其性质和制备收到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) 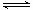 4NO2(g)+O2(g) ;⊿H>0
4NO2(g)+O2(g) ;⊿H>0
①反应达到平衡后,若再通入一定量氩气,则N2O5的转化率将___(填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| c(N2O5)/mol·L—1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为______________。
③一定温度下,在2L恒容密闭容器中加入2mol N2O5,达到平衡时,气体的压强为原来的 ,(不考虑NO2聚合成N2O4),则N2O5的转化率a1=,该温度下反应的平衡常数K=_______。
,(不考虑NO2聚合成N2O4),则N2O5的转化率a1=,该温度下反应的平衡常数K=_______。
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的__________区生成,其电极反应式为_________________________________。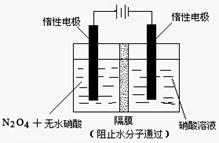
(3)如图:V(NO):V(O2)=3:1。当抽去NO和O2之间的隔板后,NO和O2反应后成NO2,部分NO2聚合成N2O4(N2O4此时为气态)。当体系达到平衡后,U形毛细管两端汞面高度差由反应前10cm变为7.1cm。假设温度不变,且隔板及U形毛细管的体积都忽略不计,此时混合气体的平均相对分子质量为__________。 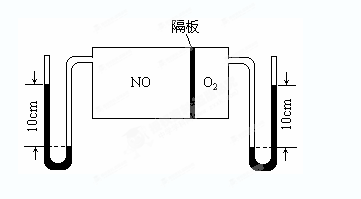
下图为中学常见物质间的转化关系,其中甲、乙、丙、丁为单质,其余为化合物,甲单质所含元素最外层电子数等于周期数,C常温下为无色液体,B焰色反应为黄色。一些在溶液中进行的反应溶液中的H2O及生成的H2O已省略。
回答下列问题:
(1)单质乙所含元素在周期表中的位置______________________。
(2)化合物F的电子式________________________。
(3)D和G反应的离子方程式___________________________________。
(4)甲和A反应的化学方程式___________________________________。这类反应一般被称做________反应,该反应的主要应用_________________。(2种)
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。

Ⅰ.测定过氧化氢的含量
(1)取10.00 mL密度为ρ g/mL的过氧化氢溶液稀释至250mL,移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。用高锰酸钾标准溶液滴定被测试样,写出滴定过程中发生反应的离子方程式: _____________________________________________________
(2)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为____________。
Ⅱ.探究过氧化氢的性质
(1)H2O2与铜的有关探究实验:将铜丝置于用硫酸酸化的H2O2溶液中,铜被迅速氧化,溶液变蓝;同时产生大量气体,经检测该气体能使余烬木条复燃,反应的离子方程式为:_________________________。
②将铜丝置于H2O2溶液中,没有气泡产生,加热溶液时,观察到铜丝表面产生大量气体,且气体能使余烬木条复燃,在该变化中铜丝所起的作用是__________,写出产生气体这一现象的反应的化学方程式__________________________。
(2)将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现,这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出,ClO-与H2O2反应的离子方程式是___________________________。
已知烃B分子内C、H原子个数比为1︰2,相对分子质量为28,核磁共振氢谱显示分子中只有一种化学环境的氢原子,且有如下的转化关系:
(1)B的结构简式是
(2)反应①是D与HCl按物质的量之比1︰1的化合反应,则D的分子式是
反应②可表示为:G + NH3 → F + HCl (未配平),该反应配平后的化学方程式是(有机化合物均用结构简式表示):
化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知: )
)
(3)甲的结构简式是。由甲苯生成甲的反应类型是
(4)乙中有两种含氧官能团,反应③的化学方程式是:
(5)普鲁卡因有两种水解产物丁和戊
①戊与甲互为同分异构体,戊的结构简式是
②戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域.该聚合反应的化学方程式是
③D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键.则D与F在一定条件下反应生成丁的化学方程式是