实验室用下图所示装置进行氨气实验。

(1)试管中发生反应的化学方程式是_________________。
(2)干燥管中盛放的干燥剂是_______________(填名称)。
(3)请在方框中画出收集一烧瓶氨气的装置。
(4)检验氨气是否收集满,可选用_________试纸,实验现象是_______________。
(5)用右图装置做喷泉实验。轻轻挤压滴管,使少量水进入烧瓶,打开止水夹,观察到的现象是 ,出现这一现象的原因是 。
可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空:
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序的操作是________________________________________。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是__________________。
(3)实验中加热试管的目的是:
①____________________________________________________________________________。
②____________________________________________________________________________。
(4)试管b中加有饱和Na2CO3溶液,其作用是_________________________________________
______________________________________________________________________________。
(5)反应结束后,振荡试管b静置,观察到的现象是_________________________________
_______________________________________________________________________________
有效地利用现有能源和开发新能源已受到各国的普遍重视。
(1)可用改进汽油组成的办法来改善汽油的燃烧性能,例如,加入CH3OC(CH3)3来生产“无铅汽油”。CH3OC(CH3)3分子中必存在的原子间连接形式有__________________(填写编号)。
①C="=O" 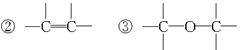
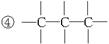
(2)天然气的燃烧产物无污染、热值高、管道输送方便,将成为我国西部开发的重点之一。天然气常和石油伴生,其主要成分是_____________。能说明它是正四面体而非正方形平面结构的理由是_____________(填写编号)。
①其一氯代物不存在同分异构体 ②其二氯代物不存在同分异构体
③碳原子与氢原子之间以共价键结合 ④四个碳氢键是完全等价的
(3)1980年我国首次制成一辆燃氢汽车,乘员12人,以50 km·h-1行驶了40 km。为了有效发展民用氢能源,首先必须制得廉价的氢气。下面可供开发又较经济的制氢方法是_____________(填写编号)。
①电解水 ②锌和稀硫酸反应 ③光解海水
其次,制得氢气后还需要解决的问题是______________________________(写出其中一个)。
某厂利用一种天然产物进行发酵,发现发酵液中含有U、V、W、X等多种化合物。已知:①U和W均可与银氨溶液反应,析出金属银,而且U是一种单糖;②V是个单官能团化合物,其碳原子数和X相同,V在浓硫酸作用下经加热得到Y,Y可以使溴水褪色;③V经缓和氧化可以生成W;④V和X在少量浓H2SO4作用下经加热可以得到Z;⑤X的组成为:C:40%、H:6.7%、O:53.3%,X含有一个羧基,并知450 mg X与25 mL 0.20 mol/L与NaOH溶液完全反应,X也可和乙醇起酯化反应。根据上述条件:
(1)写出符合U的一种可能的单糖结构简式:_______________。
(2)X的分子式是_______________,其所有可能的结构简式是____________________。
(3)V、W、Y、Z的可能结构简式分别是:V______________;W______________;Y______________;Z______________。
某学生采用下面的装置及实验方法来测定推断乙醇的分子结构。
(1)该学生分别准备称取4.60 g乙醇进行多次实验,结果发现已排到量筒内的水的体积作为生成氢气的体积换算成标准状况下的体积都小于1.12 L。若忽略量筒本身及读数造成的误差,那么该学生认为是由于样品中含有少量水造成的,你认为正确吗?_________________(填“正确”或“不正确”)。如果你认为正确,请说明理由;你认为不正确,那么产生这种情况的原因应是什么?
____________________________________________________________。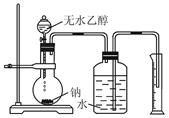
(2)该学生认为实验成功的关键有:
①装置气密性良好 ②实验开始前要准确确定乙醇的量 ③钠足量 ④广口瓶内必须充满水 ⑤氢气的体积测算方法正确、数据准确
你认为,其中正确的有_______________(填序号)。
(3)实验后,该学生从乙醇的可能结构分析入手,对乙醇和钠的关系进行讨论,若乙醇的物质的量为n mol,则对钠的物质的量取值要求必须是________________。
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取W g 该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现按下图所示装置
进行实验:
回答下列有关问题:
(1)E装置的作用是___________________________________________________________。
(2)需要加热的装置是_________________________________________________________。
(3)写出氨基酸燃烧的方程式___________________________________________________。
(4)D的作用是_______________________________________________________________。
(5)F处读数时应注意的问题:_________________________________________________。
(6)还须测定的数据有_________________________________________________________。