相同条件下,相同浓度的盐酸分别与镁、铝、铁3种金属恰好完全反应,产生相同体积的氢气(相同状况下),则下列说法正确的是( )
| A.开始时,产生氢气的速率相同 |
| B.参加反应的金属的物质的量比为1∶1∶1 |
| C.所得溶液的质量相等 |
| D.参加反应的金属的质量比为12∶9∶28 |
25℃时,有c(CH3COOH)+c(CH3COO-)=" 0." 1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是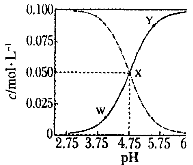
| A.X点所表示的溶液中:c(Na+)+ c(OH-) = c(CH3COO-) + c(H+) |
| B.W 点所表示的溶液中:c(Na+) +c(H+) -c(OH-) +c(CH3COOH)=" 0." 1mol·L-1 |
| C.该温度下醋酸的电离平衡常数为10-4.75 mol·L-1 |
| D.向X点所表示的溶液中加入等体积的0. 05mol·L-1NaOH溶液:c(H+)= c(CH3COOH)+c(OH-) |
某温度下HF的电离常数Ka=3.3×10-4 mol·L-1,CaF2的溶度积常数Ksp=1.46×10-10(mol·L-1)3。在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是()
| A.该温度下,0.31 mol·L-1的HF溶液的pH=2 |
| B.升高温度或增大浓度,HF的电离平衡常数都将增大 |
| C.两溶液混合不会产生沉淀 |
| D.向饱和的CaF2溶液中加水后,c(Ca2+)一定比加水前减小 |
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
下列说法正确的是()
| A.上述生成Ni(CO)4(g)的反应为吸热反应 |
B.25℃时反应Ni(CO)4(g)  Ni(s)+4CO(g)的平衡常数为0.5(mol·L-1)3 Ni(s)+4CO(g)的平衡常数为0.5(mol·L-1)3 |
| C.在某条件下达到平衡,测得Ni(CO)4、CO浓度均为0.5mol/L,则此时温度高于80℃ |
| D.80℃达到平衡时,保持体积不变,往体系中充入一定量的CO,再次达到平衡后CO的体积分数减小 |
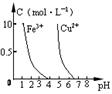
下列图示与对应的叙述相符的是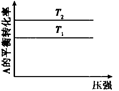


甲乙丙丁
A.图甲可以判断出反应A(g) + B(g) 2C(g) 的△H<0,T2>T1 2C(g) 的△H<0,T2>T1 |
B.图乙表示压强对可逆反应2A(g) + 2B(g) 3C(g) + D(s)的影响,乙的压强比甲的压强大 3C(g) + D(s)的影响,乙的压强比甲的压强大 |
| C.据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH≈4 |
| D.图丁表示25℃时,用0.1 mol·L—1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入盐酸体积的变化 |
普伐他汀是一种调节血脂的药物,其结构如图。下列关系普伐他汀的性质描述不正确的是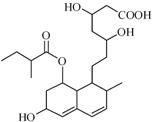
| A.能与FeCl3溶液发生显色反应 |
| B.能使酸性KMnO4溶液褪色 |
| C.能发生加成、取代、消去反应 |
| D.1mol该物质在溶液中最多可与2molNaOH反应 |