ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)氧元素能形成繁多的氧化物,请写出一个与CO2等电子的化合物_________________;
(2)把Na2O、SiO2、P2O5三种氧化物按熔沸点由高到低顺序排列_________________;
(3)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为_________________;
(4)Se原子基态核外电子的排布式为_________________;
(5)SO32-离子中硫原子的杂化方式__________,该离子的立体构型为____________;
(6)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。X与Y所形成化合物晶体的晶胞如图所示。
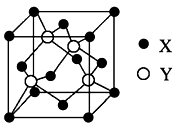
①在一个晶胞中,X离子的数目______,该化合物的化学式为______________;
②Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 ;
③Y与Z可形成YZ42-。YZ42-的空间构型为_________(用文字描述);写出一种与YZ42-互为等电子体的分子的化学式____________;
④X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ 键的数目为________;
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
(1)图中试剂①~⑤溶质的化学式分别是:
①_________,②__________,③____________,④_________,⑤_________________。
(2)图中现象a、b、c表明检验出的离子分别是:A____________、b____________、c_______________。
(3)白色沉淀A加试剂②反应的离子方程式是_________________________。
(4)无色溶液C加试剂③的主要目的是___________________________。
(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是__________________________。
(6)气体E通入试剂④发生反应的离子方程式是____________________________________。
某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A露置在空气中足够长时间变为C,B和酸性气体D能生成C,A和B都能与水生成E,E和D也能生成C。回答下列问题。
(1)写出下列物质的化学式:C,D,E。
(2)写出下列反应的化学方程式:
A和水生成E:。
②B和D生成C:。
③Cl2与E的水溶液:。
短周期的四种主族元素W、X、Y、Z,原子序数依次变小,四种元素的原子核外电子层数之和为8。X元素的原子最外层电子数等于Y和Z两元素的原子最外层电子数之和。W元素和Y元素的原子最外层上的电子数分别是各自电子层数的2倍。X和Z可以形成XZ3的气态化合物。
(1)写出元素名称:W__________,X____________,Y__________,Z__________。
(2)(XZ4)2W属于离子化合物,写出此化合物的电子式_________________。
(3)A物质是一种酸,它的一个分子里含有一个W原子,一个X原子,一个Y原子和一个Z原子,四个原子共形成五对共用电子对,请写出该物质的结构式__________。A物质的钾盐溶液常用检验_________(填写一种阳离子符号)。
(4)已知W、X、Y、Z四种元素可两两组成多种微粒,请写出其中所含电子数均为10的三种微粒______________________________________。
人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
负极反应式为。
正极反应式为。
(2)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为,若将此反应设计成原电池,则负极所用电极材料为,正极反应式为。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为。
| A.铝片、铜片 | B.铜片、铝片 | C.铝片、铝片 | D.铜片、铜片 |
写出插入烧碱溶液中形成原电池的负极反应式:。
(4)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是__________(填“a”或“b”),该极的电极反应式是:________________。
②电池工作一段时间后电解质溶液的pH_________(填“增大”、“减小”或“不变”)。
表是元素周期表的一部分。(注意:以下各空请用化学术语答题,不能用字母代替)
| 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O族 |
| 1 |
||||||||
| 2 |
G |
H |
D |
|||||
| 3 |
B |
C |
E |
|||||
| 4 |
F |
A |
(1)A~H八种元素中:
a.原子半径最小的元素对应的单质是,还原性最强的单质是。
b.最高价氧化物对应的水化物酸性最强的酸的化学式是。
(2)C元素的离子结构示意图,用电子式表示AD2的形成过程。
(3)G元素的最高价氧化物的电子式。