锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-=C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料)
正极反应:Li1-xMO2+xLi++x e-=LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是( )
| A.锂离子电池放电时电池反应为LiMO2+C6Li1-x=C6Li+Li1-xMO2 |
| B.锂离子电池充电时电池内部Li+向负极所连的电极移动 |
| C.锂离子电池放电时电池内部电流从负极流向正极 |
| D.锂离子电池充电时阳极反应为C6Li1-x+xLi++xe-=C6Li |
下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是 ( )
①热纯碱溶液的洗涤油污能力强;②误将钡盐[BaCl2.Ba(NO3)2]当作食盐食用后,常用0.5℅的Na2SO4溶液解毒;③溶洞.珊瑚的形成;④碳酸钡不能做“钡餐”而硫酸钡则能;⑤泡沫灭火器灭火的原理。
| A.②③④ | B.①②③ | C.③④⑤ | D.全部 |
下列说法正确的是 ( )
| A.硫酸钡放入水中不导电,则硫酸钡是非电解质 |
| B.物质溶于水达到饱和时,溶解过程就停止了 |
| C.绝对不溶解的物质是不存在的 |
| D.某离子被沉淀完全是指该离子在溶液中的浓度为零 |
已知Zn(OH)2的溶度积常数为1.2×10-17 mol3/L3,则它在水中的溶解度为 ( )
| A.1.4×10-6 mol/L | B.2.3×10-6 mol/L |
| C.1.4×10-9 mol/L | D.2.3×10-9 mol/L |
对于表达式PbI2(s)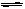 Pb2+(aq)+2I-(aq),下列描述正确的是 ( )
Pb2+(aq)+2I-(aq),下列描述正确的是 ( )
| A.说明PbI2难电离 | B.说明PbI2难溶解 |
| C.这是电离方程式 | D.这是沉淀溶解平衡表达式 |
向AgCl饱和溶液中加水,下列叙述正确的是 ( )
| A.溶解度.Ksp均不变 | B.溶解度.Ksp均变大 |
| C.结晶过程停止,溶解过程加快 | D.结晶过程将小于溶解过程,直至再达到平衡 |