右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
现用该浓硫酸配制980 mL 0.1 mol/L的稀硫酸。可供选用的仪器有:

①胶头滴管;②烧瓶;③烧杯;④ 药匙;⑤量筒;⑥托盘天平⑦玻璃棒
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),还缺少的仪器有 (写仪器名称);
(2)配制0.1mol/L的稀硫酸980mL需用量筒量取上述浓硫酸体积为 mL。
(3)实验中两次用到玻璃棒,其作用分别是: 、 。
(4)配制时,一般可分为以下几个步骤:①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序为 。(填序号)
(5)在配制过程中,下列操作可引起所配溶液浓度偏高有 (填序号)。
①洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒
⑤定容时,俯视刻度线
某化学兴趣小组,拟探究和比较SO2和C12的漂白性,设计如下图所示的实验装置二套。请你参与探究并回答下列问题。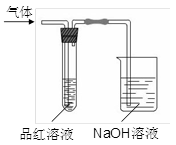
(1)向第一套装置中通入一段时间的SO2,观察到试管中的品红溶液褪色,然后再加热试管,溶液(填“恢复”或“不恢复”)红色;
(2)向第二套装置中通入一段时间的C12,观察到试管中的品红溶液也褪色,然后再加热试管,溶液(填“恢复”或“不恢复”)红色;
(3)由以上两个实验可以说明SO2和C12的漂白原理(填“相同”或“不相同”);
(4)C12通入品红溶液中,生成的具有漂白性的物质是(填“HC1”或“HClO”)。
(共16分)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图: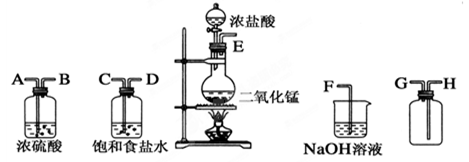
(1)连接上述仪器的正确顺序(填各接口处的字母):E接________;__________接__________;
________接________;__________接F。
(2)装置中,饱和食盐水的作用是______________;浓硫酸的作用是____________。
(3)化学实验中检验是否有Cl2产生的常用方法是________,反应的离子方程式_____________。
(4)写出下列反应的化学方程式:
①气体发生装置中进行的反应:____________________________________。
②NaOH溶液中发生的反应:______________________________________。
(5)如果将10 mL 12 mol·L-1的浓盐酸与足量MnO2充分反应,实际能收集到的氯气在标准状况下的体积将________。
| A.≥ 0.672L | B.> 0.672 L | C.≤ 0.672 L | D.< 0.672 L |
某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(I)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mL O2所需的时间(秒)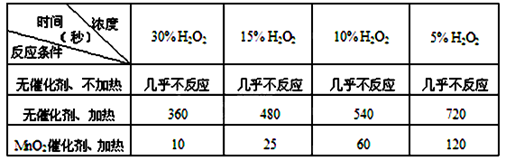
①研究小组在设计方案时。考虑了浓度和因素对过氧化氢分解速率的影响。
②上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响。
(Ⅱ)将质量相同但聚集状态不同的MNO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
| 催化剂(MNO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
| 粉末状 |
混合 不振荡 |
剧烈反应,带火星的木条复燃 |
3.5分钟 |
| 块状 |
反应较慢,火星红亮但木条未复燃 |
30分钟 |
①写出H2O2发生的化学反应方程式。
②实验结果说明催化剂作用的大小与有关。
溴苯是一种化工原料,实验室用以下甲、乙、丙、丁等仪器组合,合成溴苯的装置示意图(其余辅助仪器略去)及有关数据如下,按要求回答下列问题:
| 苯 |
溴 |
溴苯 |
|
| 密度/g·cm-3 |
0.88 |
3.10 |
1.50 |
| 沸点/°C |
80 |
59 |
156 |
| 水中溶解度 |
微溶 |
微溶 |
微溶 |
(1)仪器乙的名称为:;
(2)用上图的装置制备溴苯时的操作为:向甲中预先加入少量铁屑,再加入适量苯,丙中预先装好适量液溴,将丙中所装的液溴缓慢滴入甲中,充分反应。反应中铁屑的作用是:;写出制备溴苯的化学反应方程式是:;
(3)丁装置烧杯中倒置的漏斗的目的是:;写出丁中发生的主要化学反应的方程式为:;
(4)充分反应后,向甲中加入适量水,然后过滤除去未反应的铁屑;所得到滤液就是制得的粗溴苯,其中含有未反应完的液溴,最好应选择试剂除去,
A.氢氧化钠溶液 B.稀盐酸溶液C.氯化钠溶液D.水
经过上述操作所得的粗溴苯中还含有杂质苯,要进一步提纯,应选下列哪种操作除去。
E.重结晶 F.过滤G.蒸馏 H.萃取
某课外学习小组在学习了Na2O2与CO2的反应后,认为Na2O2与SO2应该也可以反应。他们设计了下图装置(夹持装置已略去,装置的气密性良好)进行实验,探究SO2与Na2O2反应的产物,请按要求回答下列问题。
Ⅰ﹒写出装置A中发生反应的化学方程式:___________________________
Ⅱ﹒装置D的作用:除了可以防止空气中的CO2、水蒸气等进入C中与Na2O2反应,还可以_____________
Ⅲ﹒在通入足量的SO2与Na2O2充分反应后,他们对C中固体产物提出如下假设:
假设1:只有Na2SO3;
假设2:_________;
假设3:既有Na2SO3,又有Na2SO4。
(1)若假设1成立,写出SO2与Na2O2反应的化学方程式:________________
(2)为进一步确定C中反应后固体产物的成分(Na2O2已反应完全),甲同学设计了如下实验:
甲同学由此得出结论:产物是Na2SO4,该方案是否合理______(填“是”或“否”),理由是_____________
(3)乙同学设计了如下实验验证假设3成立,请帮助他完成下表。
| 实验步骤 |
现象 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解。 |
固体全部溶解 |
| ②向上试管中加入过量的_____________,将产生的气体通入少量酸性KMnO4溶液中。 |
KMnO4溶液__________ |
| ③向步骤②反应后的试管中,加入适量的BaCl2溶液。 |
产生白色沉淀 |
步骤②中将产生的气体通入少量酸性KMnO4溶液中,发生反应的离子方程式为:__________