在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+c(s) 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
A.反应CO2(g)+C(s) 2CO(g) △S>0、△H<0 2CO(g) △S>0、△H<0 |
| B.体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ) |
| C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) |
| D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态)) |
温总理在十届全国人大四次会议上所作的“政府工作报告”中指出:“抓好资源节约,建设环境友好型社会”,这是我国社会及经济长期发展的重要保证。你认为下列行为中有悖于这一保证的是()
| A.开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料 |
| B.将煤进行“气化”和“液化”处理,提高煤的综合利用效率 |
| C.研究采煤、采油新技术,提高产量以满足工业生产的快速发展 |
| D.实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) |
当反应达到平衡时,下列措施:①升温②恒压通入惰性气体,③增加 的浓度④减压⑤加催化剂⑥恒容通入惰性气体;能提高 转化率的是()
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ③⑤⑥ |
关于下列各图的叙述,正确的是()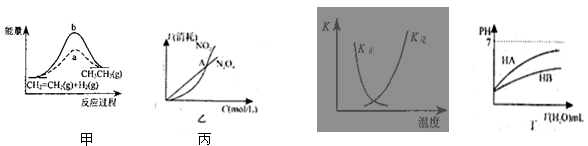
| A.图甲中a、b曲线分别表示反应CH2=CH2 (g) + H2(g)→CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 |
B.图乙表示恒温恒容条件下发生的可逆反应2NO2(g)  N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
C.图丙中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
| D.图丁中起始时HA的物质的量浓度大于HB |
下列说法不正确的是()
A.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,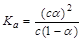 。若加入少量醋酸钠固体,则CH3COOH 。若加入少量醋酸钠固体,则CH3COOH CH3COO-+H+向左移动,α减小,Ka变小 CH3COO-+H+向左移动,α减小,Ka变小 |
B.常温下,反应 不能自发进行,则该反应的 不能自发进行,则该反应的 |
C.一定温度下,氯化铵水解离子方程式:NH+4+H2O NH3·H2O+H+,若用KW表示的离子积, NH3·H2O+H+,若用KW表示的离子积,Kb表示氨水电离常数,则氯化铵水解平衡常数K=KW/Kb |
| D.一种“人工固氮”的新方法是在光照条件下,N2茌催化剂表面与水蒸气发生反应生成NH3和氧气,己知: |

则“人工固氮”新方法的热化学方程式可表示为: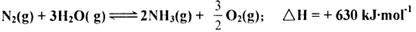
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)  4NO2(g)+O2(g) ΔH > 0T1温度下的部分实验数据为:
4NO2(g)+O2(g) ΔH > 0T1温度下的部分实验数据为:
| t/s |
0 |
500 |
1000 |
1500 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法不正确的是()
A.500 s内N2O5分解速率为2.96×10-3 mol·(L·s)-1
B.T1温度下的平衡常数为K1=125, 1000 s时转化率为50%
C.其他条件不变时,T2温度下反应到1000 s时测得N2O5(g)浓度为2.98 mol·L-1,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3