检验溶液中是否含有某种离子,下列操作方法正确的是:
| A.加入AgNO3溶液,有白色沉淀生成,证明含有Cl- |
| B.加入BaCl2溶液,产生白色沉淀,证明有SO42- |
| C.加浓NaOH溶液后加热,产生使润湿的红色石蕊试纸变蓝色的气体,证明有NH4+ |
| D.加入盐酸,放出能使澄清的石灰水变浑浊的气体,证明有CO32- |
四种基本类型反应与氧化还原反应的关系可用下列哪个图所示 ()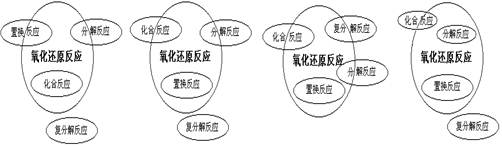
A B C D
下列说法正确的是()
| A.非标准状况下,1mol任何气体的体积都不可能是22.4L |
| B.25℃﹑101kPa下,44 g CO2和28 g CO所占的体积相同 |
| C.标准状况下,1mol水的体积是22.4L |
| D.当微粒数目相同时,气体物质的体积主要决定于微粒本身的大小 |
科 学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进 行深入的研究。下列4组物质:①Mg、O2、N2、NO②NaOH、Na2CO3、CH4、KCl;③H2CO3、H2SO4、NH3·H2O、H2SiO3;④CaO、SO2、CO2、SiO2。从物质的基本分类看,每组中都有一种物质与其他物 质不同属于同一类,这4种物质分别是: ()
| A.NO、CH4、NH3·H2O、CaO | B. O2、NaOH、H2SO4、SiO2 |
| C.Mg、Na2CO3、 H2CO3、CaO | D. NO、KCl、H2SiO3、SO2 |
在标准状况下,一个装满氧气的容器质量为74g,若装满氮气时质量是66g,此容器的体积是()
| A.4.48L | B.11.2L | C.22.4L | D.44.8L |
现有A、B、C三种化合物,各取40g相混合,完全反应后,得B 18g,C49g,还有D生成。已知D的式量为106。现将22gA和11gB混合反应,能生成D ()
A、1m ol B、 0.5mol C、 0.275mol D、 0.25mol