将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是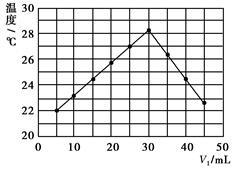
| A.做该实验时环境温度为22 ℃ |
| B.该实验表明化学能可以转化为热能 |
| C.NaOH溶液的浓度约是1.00 mol/L |
| D.该实验表明有水生成的反应都是放热反应 |
在298K、100kPa时,已知:
2 ⊿
⊿
 ⊿
⊿
 ⊿
⊿
则⊿ 与⊿
与⊿ 和⊿
和⊿ 间的关系正确的是()
间的关系正确的是()
A .⊿ =⊿
=⊿ +2⊿
+2⊿ B ⊿
B ⊿ =⊿
=⊿ +⊿
+⊿
C. ⊿ =⊿
=⊿ -2⊿
-2⊿ D. ⊿
D. ⊿ =⊿
=⊿ - ⊿
- ⊿
将1 molCO和1 molH2O混合在一定条件下反应: CO+H2O(气) CO2+H2,达到平衡时剩余了75%的CO, 此平衡混合气的密度是相同条件下氢气的
CO2+H2,达到平衡时剩余了75%的CO, 此平衡混合气的密度是相同条件下氢气的
| A.5.75倍 | B.11.5倍 | C.23倍 | D.30.67倍 |
设C+CO2⇌2CO(正反应为吸热反应),反应速率为v1,N2+3H2⇌2NH3(正反应为放热反应),反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为 ( )
| A.都增大 | B.同时减小 | C.v1增大,v2减小 | D. v1减小,v2增大 |
某反应其△H="=" —122 kJ/mol,∆S="=" 231 J/(mol·K),则此反应在下列哪种情况下可自发进行
| A.在任何温度下都能自发进行 | B.在任何温度下都不能自发进行 |
| C.仅在高温下自发进行 | D.仅在低温下自发进行 |
对某一可逆反应来说,使用催化剂的作用是
| A.提高反应物的平衡转化率 | B.以同样程度改变正逆反应的速率 |
| C.增大正反应速率,减小逆反应速率 | D.改变平衡混合物的组成 |