如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹。丁为直流电源,x、y为电源的两极。G为电流计,电极均为石墨电极。闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:

(1)M溶液可能是 (填序号)。
A.KNO3溶液 B. Ba(OH)2溶液 C.H2SO4溶液 D. NaCl溶液 E.CuSO4溶液
(2)C极的电极反应式为 。
(3)滤纸丙的m端发生的现象为 。
(4)闭合K2、断开K1一段时间后,断开K2、闭合K1,若M溶液为KOH溶液,则A极电极反应式为 。乙池电解质溶液的pH________(填“增大”“减小”或“不变”)。
A~K为中学化学常见的物质,它们之间的转化关系如下图,部分生成物和反应条件等省略。已知C、D是由元素X、Y、Z中的两种组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色气体且不能燃烧,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。请回答下列问题: 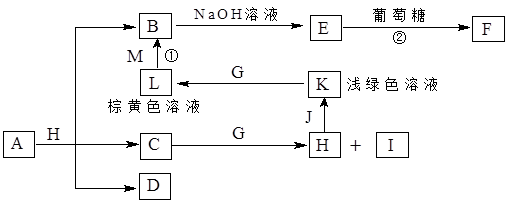
1)写出A的化学式______________。
(2)比较Y与Z的原子半径大小:_________>_______(填写元素符号)。
(3)检验L溶液中金属阳离子的方法是__________________________________。
(4)已知F溶于稀硝酸,溶液变成蓝色,放出无色气体。请写出该反应的化学方程式
________________________________________________________
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
| 实验 编号 |
实验目的 |
T/K |
PH |
c/10-3mol·L-1 |
|
| H2O2 |
Fe2+ |
||||
| ① |
为以下实验作参考 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
||||
| ③ |
298 |
10 |
6.0 |
0.30 |
[数据处理]实验测得p-CP的浓度随时间变化的关系如右上图。
(2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:
v(p-CP)=" ______________" mol·L-1·s-1
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:___________________。
(4)实验③得出的结论是:pH等于10时,_________________________________。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
.。
我国规定饮用水质量标准必须符合下列要求:
| pH |
6.5~8.5 |
| Ca2+、Mg2+总浓度 |
<0.0045 mol·L-1 |
| 细菌总数 |
<100个·mL-1 |
以下是源水处理成自来水的工艺流程示意图:
(1)源水中含Ca2+、Mg2+、HCO-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式______________________。
(2)凝聚剂除去悬浮固体颗粒的过程是_____________(填写编号)
①只是物理过程②只是化学过程③是物理和化学过程
FeSO4·7H2O是常用的凝聚剂,它在水中最终生成_____________沉淀。
(3)通入CO2的目的是____________________________和____________________。
(4)气体A的作用是____________________,这种作用是基于气体A和水反应的产物具有_______________________性。
(5)下列物质中,____________________可以作为气体A的代用品(填写编号,多选倒扣)。
①Ca(ClO)2②NH3 (l) ③K2FeO4④SO2
某固体混合物可能含有 、
、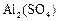 、
、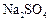 、
、 、
、 和
和 。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”) :.
。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”) :.
(1)将少许混合物放入水中得到无色溶液和白色沉淀。
| 肯定存在的物质 |
肯定不存在的物质 |
理由 |
(2)取溶液进行焰色反应,火焰呈黄色。
| 肯定存在的物质 |
肯定不存在的物质 |
理由 |
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
| 肯定存在的物质 |
肯定不存在的物质 |
理由 |
(4)通过上述实验仍无法确定的物质是。
下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验: 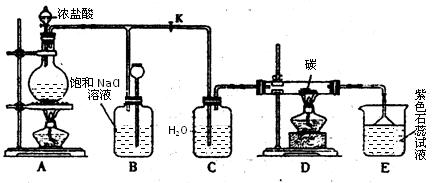
(1)A为氯气发生装置,写出反应的化学方程式________________________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式 _____;装置C的作用是 。
(3)E处石蕊试液的现象是_______________;其原因是__________________。
(4)若将E处溶液改为石灰水,反应过程的现象是_____________________________。
A.有白色沉淀生成
B.无白色沉淀生成
C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此处B中的现象是________________,B的作用是________________。