将一定质量的铜溶于50mL11mol/L的浓硝酸中,待铜完全溶解后,生成0.2molNO2和NO的混合气体,并测得溶液中H+的浓度为1mol/L.假设反应后溶液的体积仍为50mL,则金属铜的质量为( )
| A.6.4g | B.9.6g | C.11.2g | D.12.8g |
化学与数学有密切的联系,将某些化学知识用数轴表示,可以得到直观形象、简明易记的良好效果。下列用数轴表示的化学知识中错误的是()
A.铁与稀硝酸反应后溶液中铁元素的存在形式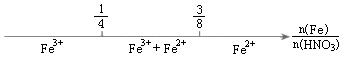 |
B.AlCl3溶液中滴加NaOH溶液后Al元素的存在形式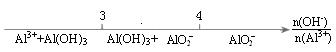 |
C.分散系的分类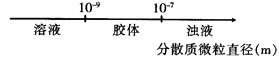 |
| D.CO2通入澄清石灰水中反应的产物 |
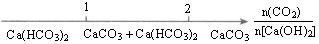
下列离子反应方程式正确的是()
A.小苏打溶液中加入过量石灰水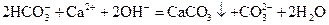 |
B.氯化铝溶液中加入过量氨水 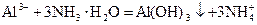 |
C.氯化亚铁溶液中通入氯气 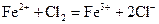 |
D.苛性钾溶液中加入稀醋酸 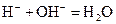 |
在溶液中可以大量共存,加OH-产生沉淀,加H+生成气体的一组离子是()
| A.Na+、Cu2+、CO32-、Cl- |
| B.Na+、 Cl-、 HCO3-、Mg2+ |
| C.Cl-、NO3-、K+、 Ca2+ |
| D.NH4+、 K+、 H+、 SO42- |
下列有关金属及其化合物的说法正确的是()
| A.由于铝在常温下不能与氧气反应,所以铝制品具有一定的抗腐蚀性能,是一种应用 广泛的金属材料 |
| B.住FeCl3溶液中滴入KI一淀粉溶液,溶液变蓝色 |
| C.向紫色石蕊试液中加入过量的Na2O2粉末,振荡,溶液变为蓝色并有气泡产生 |
| D.装修门窗使用的铝合金材料的硬度比铝小,熔点比铝低 |
下列有关说法错误的是()
| A.利用铝热反应可以冶炼熔点较高的金属 |
| B.AgI可用作人工降雨 |
| C.常温下,可以用铁制容器来盛装冷的浓硫酸 |
| D.人造刚玉熔点很高,可用作高级耐火材料,其主要成分是二氧化硅 |