运用所学知识,回答下列问题。
(1)SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程式为_________________,工艺师常用______________(填物质名称)来雕刻玻璃。
(2)向硫酸铜溶液中逐滴加入KI溶液至恰好反应完全,观察到产生白色沉淀CuI,蓝色溶液变为棕色。该反应的离子方程式为 ;取一定量上述反应后的上层棕色清液于一支试管中,加入一定量的苯,振荡,此时观察到的现象是____________________________。
(3)电子工业常用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,工程师欲从制造印刷电路板的工业废水中回收铜,并获得FeCl3溶液,设计如下方案:

①滤渣的成分为 。(填化学式)
②加过量B发生反应的离子方程式为 。
③通入C发生反应的化学方程式为 。
由乙烯和其他无机原料可合成环状化合物,其合成过程如下图所示(水及其他无机产物均已省略):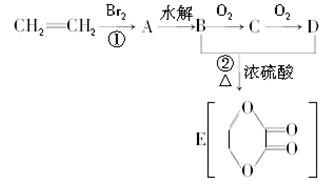
请分析后回答下列问题:
(1)反应的类型分别是①________,②________;
(2)D物质中的官能团为________;
(3)C物质的结构简式为________,物质X与A互为同分异构体,则X的结构简式为________,X的名称为________;
(4)B、D在一定条件下除能生成环状化合物E外,还可反应生成一种高分子化合物,试写出B、D反应生成该高分子化合物的方程式_______________.
某元素的原子获得能量后的电子排布式为1s22s22p63s23p34s1,则该元素
的原子获得能量前的电子排布式为 ___________;元素符号为
_______;其最高价氧化物对应的水化物的化学式是________。
水是自然界中普遍存在的一种物质,根据下列信息回答问题:
(1)已知H3O+ + OH- = 2H2O,H3O+的立体构型是_________,中心原子的杂化类型是_______。
(2)在OH-、H2O、H3O+、H2O2中均含有的化学键是
A、极性键 B、非极性键 C、配位键
(3)在20℃,1.01×105Pa,水可以结成冰,称为热冰。下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是
A、金刚石 B、干冰 C、食盐 D、固态氨
砷原子的最外层电子排布式是4s24p3,砷元素在周期表中的位置;其最高价氧化物的化学式为,砷酸钠的化学式是。
(1)苯、四氯化碳、乙醇、汽油是常见的有机溶剂,能与水互溶的是________;不溶于水,且密度比水大的是________.
(2)一瓶无色气体,可能含有CH4和CH2=CH2,或其中的一种,与一瓶Cl2混合后光照,观察到黄绿色逐渐褪去,瓶壁有少量无色油状小液滴。
①由上述实验现象推断出该瓶气体中一定含有CH4,你认为是否正确,为什么?
②上述实验中可能涉及的反应类型有___________