下列说法正确的是
| A.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| B.0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(Na+)=c(CH3COO-) |
| C.浓度均为0.10mol/L的氨水和氯化铵溶液等体积混合后:c(NH3·H2O)+c(NH4+)=0.1mol/L |
| D.pH=3的盐酸和pH=11的氢氧化钡等体积混合pH>7 |
在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl-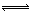 [CuCl4]2-(绿)+4H2O能使黄绿色CuCl2溶液向蓝色转化的操作是
[CuCl4]2-(绿)+4H2O能使黄绿色CuCl2溶液向蓝色转化的操作是
| A.蒸发浓缩 | B.加CuCl2固体 | C.加入AgNO3 | D.加入食盐晶体 |
在理论上不能用于设计原电池的化学反应是
| A.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) △H < 0 |
| B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H < 0 |
| C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) △H < 0 |
| D.2H2(g)+O2(g)=2H2O(l) △H < 0 |
下列描述违背化学原理的是
| A.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高 |
B.反应A(g)+3B(g) 2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大 2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大 |
| C.SO2的催化氧化是一个放热的反应,升高温度,反应速率加快 |
| D.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-= Cl2 ↑ |
利用相关数据作出的推理或判断一定正确的是
| A.用弱酸的电离常数比较相同条件下强碱弱酸盐溶液的碱性强弱 |
| B.用物质的熔沸点数据推断物质的晶体类型 |
| C.根据溶液的pH判断该溶液的酸碱性 |
| D.根据焓变数据判断反应能否自发进行 |
下列说法正确的是
| A.凡是放热反应都是自发的 | B.铁在潮湿空气中生锈是自发过程 |
| C.熵增大的反应都是自发反应 | D.电解池的反应是属于自发反应 |