把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得的浊液中,逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:

(1)混合物中NaOH的质量是 g,AlCl3的质量是 g。
(2)P点所表示盐酸加入体积为 mL。
常温下,一种烷烃A和一种单烯烃B组成的混合气体,A或B分子最多只含有4个碳原子,且B分子的碳原子数比A分子的多。
(1)将1L混合气体充分燃烧,在同温同压下得到2.5LCO2气体。试通过计算推断原混合气体中A和B所有可能的组合及其体积比,并将结果填入下表:
| 组合编号 |
A的分子式 |
B的分子式 |
A和B的体积比(VA :VB) |
| ① |
|||
| ② |
|||
| ③ |
|||
| ④ |
为进一步确定A、B分子式,继续实验:
(2)120℃时,取1L该混合气体与9L氧气混合,充分燃烧后,当恢复到120℃和燃烧前的压强时,体积增大了6.25﹪。试通过计算确定唯一符合题意的A、B的分子式。
有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(1)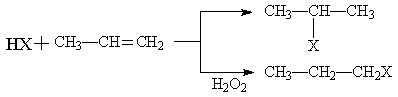 (X为卤素原子)
(X为卤素原子)
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。
(3)R—CH2OH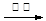 RCHO,
RCHO,
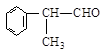 工业上利用上述信息,按下列路线合成结构简式为的物质,该物质是一种香料。
工业上利用上述信息,按下列路线合成结构简式为的物质,该物质是一种香料。
请根据上述路线,回答下列问题:
(1)A的结构简式可能为、。
(2)反应①、③、⑤的反应类型分别为、、。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是。
在催化剂和加热条件下,环丁烷和氢气能发生反应: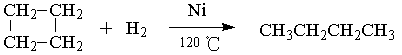
碳原子数不大于4的环烷烃可与卤素发生上述类似反应,而碳原子数大于4的环烷烃与卤素则发生取代反应。根据以上信息,完成下列问题:
一定条件下,由环丁烷可得到1,3—丁二烯(CH2=CH—CH=CH2),请用化学反应方程式表示出最简单的制备方案:。
某烷烃A,其蒸气密度是相同状况下氢气密度的64倍,经测定得知A分子中共含有6个甲基。
(1)若A不是烯烃与氢气加成的产物,则A的结构简式为:;
(2)若A是炔烃与氢气加成的产物,则A的名称为:。
露天烧烤不仅产生大量有害气体污染环境,而且在烧焦的肉类中还含有强烈的致癌物:苯并芘,其结构简式为:
(1)它是一种稠环芳香烃,其分子式为;
(2)此物质中碳元素和氢元素的质量比为。