某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是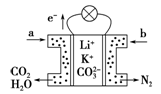
| A.a为CH4,b为CO2 |
| B.CO32-向负极移动 |
| C.此电池在常温时也能工作 |
| D.正极电极反应式为O2+2H2O+4e-="==" 4OH- |
已知NO2和N2O4可以相互转化:2NO2(g) 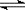 N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法正确的是
N2O4(g);△H<0。现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法正确的是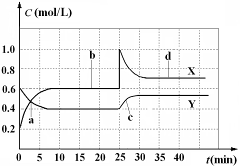
| A.图中共有两条曲线X和Y,其中曲线y表示NO2浓度随时间的变化 |
| B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和c |
| C.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4 |
| D.若要达到与d相同的状态,在25 min时还能采取的措施是适当缩小容器体积 |
关于下列各装置图的叙述中,不正确的是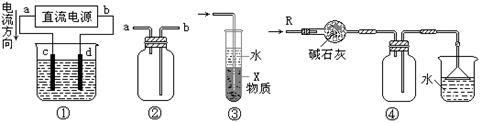
| A.装置①中,d为阳极、c为阴极 |
| B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 |
| C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| D.装置④可用于干燥、收集氨气,并吸收多余的氨气 |
设阿伏加德罗常数为NA,下列说法正确的是
| A.用100ml 4mol/L盐酸与8.7gMnO2共热能制取氯气0.2NA |
| B.一定温度下0.1L 0.1mol/L的HA和1L0.01mol/L的HA所含A-微粒数均为0.01NA |
| C.在常温常压下,44g CO2与N2O的混合物中含有的原子总数为3 NA |
| D.1mol Cl2与足量的金属铝反应,转移电子数为3 NA |
从化学角度分析,下列叙述不正确的是
| A.利用太阳能蒸馏海水是海水淡化的方法之一 |
| B.研制乙醇汽油技术,可降低机动车辆尾气中有害气体的排放 |
| C.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅 |
| D.绿色化学的核心是利用化学原理从源头上减少和消除工农业生产等对环境的污染 |
常温下,电解质溶液的性质与变化是多样的,下列说法正确的是
| A.pH相同的①CH3COONa②NaClO③NaOH三种溶液c(Na+)大小:①>②>③ |
B.往稀氨水中加水,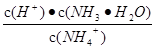 的值变小 的值变小 |
| C.pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+) = c(OH—)+2c(S2—) |
| D.Ca(ClO) 2溶液中通入少量CO2,ClO—水解程度增大,溶液碱性增强 |