金属钠在空气中充分燃烧生成的产物呈 色,将所得产物投入水中,产物和水迅速发生反应。写出产物与水反应的化学方程式: 。
(13分)X、Y、Z、W为常见含有相同电子数的离子或分子,其中X微粒含有5个原子核,这些微粒与一氧化氮间有如下转化关系(图中部分反应物、产物及反应条件已略去)。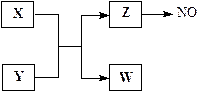
(1)Z →NO反应的化学方程式是:
液态 Z的电离与水的电离相似,电离生成电子数相同的两种微粒,写出液态Z的电离方程式。
(2)实验室中检验Z的化学试剂及现象是:
| 化学试剂 |
现象 |
|
| 方法一 |
||
| 方法二 |
(3)由构成X、Y的三种元素所组成的一种离子化合物,且三种元素原子数之比为2︰4︰3,该离子化合物是(填写化学式),其0.1 mol/L的该溶液显酸性,则该溶液中离子浓度由大到小的顺序为。
(4)一定条件下,Z与一氧化氮或二氧化氮反应均可生成两种很稳定的产物。若有二氧化氮与Z的混合气体20 mL在该条件下反应,实际参加反应的二氧化氮比Z少2 mL,则原混合气两者的体积比是:
Ⅰ现有A、B、C三种烃,其球棍模型如图: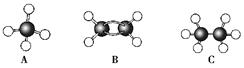
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是________(填分子式,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是____________;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是_____,生成水最多的是_____。
(4)在120℃、1.01×105 Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__________。
Ⅱ已知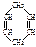 可简写为
可简写为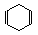 。现有某化合物W的分子结构可表示为:
。现有某化合物W的分子结构可表示为: 。
。
(1)W的分子式为;W中所有的碳原子_____(填“可能”或“不可能”)位于同一平面上,W的一氯代物有种。
(2)下列有关W的说法不正确的是(填编号);
a.能发生氧化反应 b.能发生加聚反应
c.等质量的W与苯分别完全燃烧所消耗的氧气量,前者大
(3)写出W的芳香族同分异构体(能发生聚合反应)的结构简式,该聚合反应的化学方程式为。
(4)W属于(填编号)。
a.芳香烃 b.环烃 c.不饱和烃 d.炔烃
(5)W与等物质的量的氢气发生加成反应,生成的有机物_____(填“符合”或“不符合”)苯的同系物的通式_________(用n表示碳原子个数,写出苯的同系物的通式),写出该物质属于苯的同系物的所有同分异构体:________________________________。
工业上制取冰晶石(Na3AlF6)的化学方程式如下,
2Al(OH)3+ 12HF+ 3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O,根据题意完成下列填空:
(1)在上述反应的反应物和生成物中,属于非电解质的物质的电子式为,属于弱酸的电离方程式。
(2)上述反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是(选填编号)。
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
(3)上述反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为。
(4)上述产物当中有一个物质比同族元素类似化合物的沸点高很多,写出这个物质的结构式_______,其沸点较高的原因是_______________;反应物中属于盐的物质中含有的化学键有________________。(填“离子键”或“共价键”或“金属键”)
按下列要求填空(共12分)
①向碳酸氢钙溶液中加入少量氢氧化钠溶液的离子方程式:________________________。
氯化铝溶液与NaHCO3溶液混合的离子方程式:_____________________________________。
②在KClO3 + 6HCl =" KCl" + 3Cl2↑ + 3H2O的反应中,被氧化的氯原子与被还原的氯原子的物质的量之比是_______________。
③强酸性的未知无色溶液中可能含有大量的Cl-、S2-、NO3-、CO32-、NH4+、Cu2+、Fe3+、Ag+等,现已检出有Ag+,你认为其中 __ __离子还需要鉴定是否存在,请写出检验该离子的离子方程式_____________________。
④某化合物的相对分子质量为m,在t℃时AmL该化合物的饱和溶液为Bg,将其蒸干后得到固体Cg。该化合物在t℃时的溶解度 为 __g,该饱和溶液中溶质的物质的
为 __g,该饱和溶液中溶质的物质的 量浓度为mol/L。
量浓度为mol/L。
铝土矿的主要成分是A12O3,含有Fe2O3、
SiO2等杂质,按下列操作从铝土矿中提取A12O3。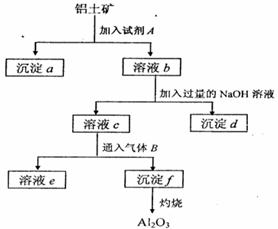
回答下列问题:
(1)沉淀物的化学式分别是: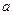
 ;d;
;d;
f;
(2)写出加入过量NaOH溶液时所发生主要
反应的离子方程式、
(3)写出通入气体B(过量)时溶液C中发生反应
的离子方程式、。
(4)气体B能否改用试剂A代替?为什么?, 。
。