将①H+、②NH4+、③NO3-、④K+、⑤CO32-、⑥OH-分别加入H2O中,基本上不影响水的电离平衡的是
| A.③④ | B.②③⑥ | C.①⑥ | D.②④ |
原子结构模型是科学家根据自己的认识,对原子结构的形象描述,一种原子模型代表了人类对原子结构认识的一个阶段。描述电子在原子核外空间的一定轨道上绕核做高速圆周运动的原子模型是( )
| A.玻尔原子模型 |
| B.电子云模型 |
| C.汤姆生原子模型 |
| D.卢瑟福原子模型 |
以mD、mp、mn分别表示氘核、质子、中子的质量,则( )
| A.mD=mp+mn |
| B.m D=mp+2mn |
| C.mD>mp+mn |
| D.mD<mp+mn |
“飞秒(10-15s)化学”使运用激光光谱技术观测化学反应时分子中原子的运动成为可能,你认为利用该技术不能观察的是( )
| A.原子中原子核的内部结构 |
| B.化学反应中原子的运动 |
| C.化学反应中生成物分子的形成 |
| D.化学反应中反应物分子的分解 |
氢原子的电子云图中小黑点表示的意义是( )
| A.1个小黑点表示一个电子 |
| B.黑点的多少表示电子个数的多少 |
| C.表示电子运动的轨迹 |
| D.表示电子在核外空间出现机会的多少 |
下列说法正确的是( )
| A.某粒子核外电子排布为2、8、8结构,则该粒子一定是氩原子 |
| B.最外层电子达稳定结构的粒子只能是稀有气体的原子 |
| C.F-、Na+、Mg2+、Al3+是与Ne原子具有相同电子层结构的离子 |
D.NH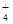 与H3O+具有相同的质子数和电子数 与H3O+具有相同的质子数和电子数 |