原电池和电解池都能实现能量的置换。回答下列问题:
(1)可将化学能转化为电能是_________池;
(2)下列反应能设计成原电池的是:
① 2FeCl3+Fe=3FeCl2
② AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③ NaOH+HC1=NaC1+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为: 。
(4)右图装置当闭合电键时,电表显示有电流通过。则Pt极的电极反应式: ; 当甲中产生0.1 mol气体时,乙中析出铜的质量应为________g。

(1)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)∶ CO(g)+2H2(g) CH3OH(g).
CH3OH(g).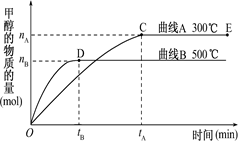
根据题意和所给图象完成下列各题:
①反应达到平衡时,平衡常数表达式K=,
②升高温度,K值(填“增大”“减小”或“不变”)
(2)一定温度下,将3 mol A气体和1 mol B气体通入一密闭容器中,发生如下反应:3A(g) + B(g) xC(g) 请填写下列空白:若容器体积固定为2 L,反应2 min时测得剩余0.6 mol B,C的浓度为0.4 mol/L。
xC(g) 请填写下列空白:若容器体积固定为2 L,反应2 min时测得剩余0.6 mol B,C的浓度为0.4 mol/L。
①x=
②平衡混合物中,C的体积分数为50%,则B的转化率是______________。
(3)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式。
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应为反应(选填“吸热”、“放热”)。
(2)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡移动(选填“向正反应方向”、“向逆反应方向”、“不”)。
(3)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K1.0(选填“大于”、“小于”、“等于”)
(4)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、
2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为。(选填“正反应方向”、“逆反应方向”、“不移动”)
密闭容器中发生如下反应:2X(g)+Y(g) Z(g);△H <0
Z(g);△H <0
下图表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5时刻外界条件有所改变,但各物质的用量都没有改变。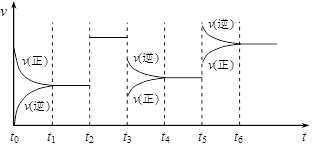
(1)t2 时外界条件的改变可能是(填序号,下同);t5时外界条件的改变可能是
a.加入催化剂 b.减小压强 c.增大压强 d.升高温度
(2)t3 时,反应物X的转化率(填“大于”、 “小于”或“等于”)t4时的反应物X的转化率。
(3)在 t 6时,固定容器体积,再向上述容器中充入1 mol氦气,此时,平衡(填“是”或“否”)会发生移动。
(4)T℃时,若将2 mol X和1 mol Y在1 L的容器中混合,在 t1(t1=2s)时达到平衡,测得Z的浓度为0.5 mol·L-1,则2s 内用物质X表示的平均反应速率为;t1时反应物Y的转化率为;T℃时,该反应的平衡常数为。
2SO2(g)+ O2(g) 2SO3(g)△H =- a kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
2SO3(g)△H =- a kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答: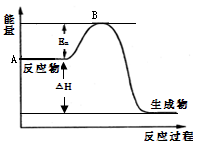
⑴图中A点表示__________________,a=__________。
⑵Ea的大小对该反应的△H _______(填“有”或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点_________(填“升高”、“降低”或“不变”)。
⑶已知单质硫的燃烧热为296kJ·mol-1,写出反应的热化学方程式:_____________________,常温常压下,由单质硫和氧气经两步反应,生成3 mol SO3(g),放出的总热量为____。
(12分)电解原理在化学工业中有广泛应用。右图表示一个电解池,其中a为电解质溶液, X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: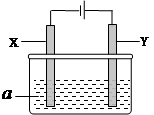
(1)X的电极名称是(填写“阳极”或“阴极”)。
(2)若X、Y都是惰性电极,a是饱和食盐水,实验开始时,同时在两边各滴入几滴酚酞试液,一段时间后,在X极附近观察到的现象是,Y极上的电极反应式为
(3)若X、Y都是惰性电极,a是CuSO4溶液,电解一段时间后,阳极上产生气体的体积为0.224L(标准状况下),则阴极上析出金属的质量为g。
(4)若要用该装置电解精炼粗铜,电解液a选用CuSO4溶液,则Y电极的材料是。
(5)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是。
| 方案 |
X |
Y |
a溶液 |
| A |
银 |
石墨 |
AgNO3 |
| B |
银 |
铁 |
AgNO3 |
| C |
铁 |
银 |
Fe(NO3)3 |
| D |
铁 |
银 |
AgNO3 |