某同学用右图所示的装置及药品进行酸性强弱比较的实验,下列说法不正确的是
| A.①和②中发生的反应均为复分解反应 |
| B.向Na2SiO3饱和溶液中滴酚酞溶液无明显现象 |
| C.一段时间后②中有胶冻状物质生成 |
| D.该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸 |
下列化学用语中,书写正确的是
| A.乙烯的结构简式:CH2CH2 |
| B.水的结构式:H—O—H |
C.氨分子的电子式: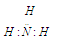 |
D.硫原子的结构示意图: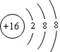 |
某溶液中除H+、OH-外,还含有大量的Mg2+、Fe3+、Cl-,且这三种离子物质的量浓度之比为1:1:6。下列有关该溶液的判断正确的是
| A.向该溶液中加入KI溶液后,原有的五种离子物质的量不变 |
| B.向该溶液中滴加稀NaOH溶液,立即出现白色沉淀 |
| C.若溶液中c(Cl-)=0.6mol/L,则该溶液的pH为1 |
| D.向该溶液中加入过量铁粉,只发生置换反应 |
下列说法不正确的是
| A.向AlCl3溶液中滴加氨水,产生白色沉淀,再加入盐酸,沉淀消失 |
| B.向铜粉中加入稀硫酸,铜粉不溶解;再加入Cu(NO3)2固体,铜粉溶解 |
| C.向BaCl2溶液中加入Na2SO3溶液,产生沉淀,再加入硝酸沉淀全部溶解 |
| D.向Fel2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色 |
今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液无沉淀产生,加热后,收集到气体0.03mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量变为2.33g。
根据上述实验,下列推测正确的是
| A.依据电荷守恒,推测一定存在K+和NH4+ |
| B.100mL溶液中含0.01mol CO32- |
| C.Ba2+一定不存在,Mg2+可能存在 |
| D.2.33g沉淀中含BaCO3和BaSO4 |
在由水电离产生的H+浓度为1×10-13 mol/L的溶液中,一定能大量共存的离子组是
①K+、Cl-、NO3-、S2-;②K+、Fe2+、I-、SO42 -;
③Na+、Cl-、NO3-、SO42 -④Na+、Ca2+、Cl-、HCO3-⑤K+、Ba2+、Cl-、NO3-
| A.①③ | B.③⑤ | C.③④ | D.②⑤ |