利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:

已知:Zn及其化合物的性质与Al及其化合物的性质相似。
回答下列问题:
(1)步骤I中所用的试剂是___________。
(2)步骤III中反应的离子方程式是__________________________________。
(3)步骤V可选用的试剂是_________(填序号)。
a.NaOH溶液 b.氨水 c.盐酸
(4)步骤VI的实验操作是_____________。
某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:
(1)步骤②发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示为。
(2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨(包括第③步被硝酸吸收的氨)的体积分数最大值为。
(3)假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c,硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是。(用含a,b,c的表示式)。
有一同学探究二氧化硫分别与BaCl2溶液、Ba(OH)2溶液反应的实验。请回答有关问题。
(1)少量SO2通入到Ba(OH)2溶液中的离子反应方程式为。
过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为。
(2)该同学将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉 淀的成分,他设计了如下实验流程:
则操作①的名称为,试剂A的化学式为。
(3)实验证明,加入试剂A后,白色沉淀未见溶解,试推测产生该白色沉淀的离子方程式是。
近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下: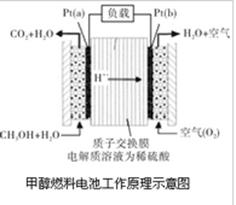
请回答下列问题:
(1)Pt(a)电极对应发生的电极反应为。Pt(b)电极反生反应(填“氧化”或“还原”),电极反应为。
(2)电池的总反应方程式为。
(3)如果该电池工作时电路中通过2mol电子,则消耗的CH3OH有mol。
如图I是广州亚运会开幕式“红棉花开迎宾来”焰火盛宴的一个场景,请回答下列问题:
(1)焰火利用了部分金属的元素特征的()反应。
(2)现在有一种火焰的引发是当浓H2SO4滴下去跟氯酸钾起作用时,便生成了其臭的二氧化氯气体,且发现只有氯元素的化合价发生变化,请写出该反应的方程式。
(3)如图2所示的五元环代表A,B,C,D,E五种物质,圆圈交叉部分指两种化合物含有一种相同元素,五种物质有五种短周期元素组成,每种化合物仅含两种元素,A是沼气的主要成分,B,E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液时医疗上广泛使用的消毒剂,E的分子结构模型为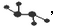 C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数比为3:2.根据上信息回答下列问题:
C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数比为3:2.根据上信息回答下列问题:
①D的化学式是;
②B的电子式是;
③C与纯碱反应的化学方程式为。
某小组学生想研究不同物质对双氧水分解速率的影响,以生成气体量50mL为标准,设计了如下实验方案:
| 实验序号 |
双氧水体积 |
双氧水浓度 |
添加的物质 |
待测数据X |
| 1 |
100mL |
20% |
无 |
|
| 2 |
100mL |
20% |
10gMnO2 |
|
| 3 |
100mL |
20% |
10gKI |
|
| 4 |
100mL |
20% |
新鲜猪肝 |
(1)在该研究方案中,MnO2、KI和猪肝在双氧水分解的过程中可能起到的作用。
(2)待测数据X为。
(3)以下措施可以加快该实验中双氧水分解速率的是:(填标号)。
A.将双氧水的体积增大至200mL
B.将双氧水的浓度增大至30%
C.对装置A加热
D.上下移动B装置使量气管内气体压强增大
(4)从控制变量的原理来看,该方案是否合理(填“是”或“否”)。理由是: