某种有机物结构简式如右图所示。有关该物质的说法正确的是:
| A.一定条件下1mol该物质能与1molH2发生加成反应 |
| B.该有机物能与FeCl3溶液发生显色反应 |
| C.该有机物能与碳酸氢钠溶液反应 |
| D.该有机物是苯酚的同系物 |
下列物质中,既含离子键又含非极性共价键的是()
| A.MgCl2 | B.CO2 | C.Na2O2 | D.N2 |
下列反应既属于氧化还原反应,又是吸热反应的是()
| A.灼热的碳与CO2的反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.铝片与稀盐酸的反应 | D.甲烷在氧气中的燃烧反应 |
废弃的电子产品称为电子垃圾,其中含铅、汞等有害物质、危害严重。下列对电子垃圾处理应予提倡的是()
①将电子垃圾掩埋地下
②改进生产工艺,减少有害物质使用
③依法要求制造商回收废旧电子产品
④将电子垃圾焚烧处理
| A.①③ | B.②④ | C.①④ | D.②③ |
下列物质中属于非电解质的是()
| A.氯化钾的水溶液 | B.液态氯化氢 |
| C.气态甲烷 | D.作电极的碳棒 |
NM-3和D-58是正处于临床试验阶段的小分子抗癌药物,结构如下: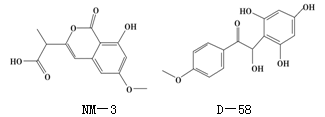
关于NM-3和D-58的叙述,错误的是()
| A.都能与NaOH溶液反应,原因不完全相同 |
| B.都能与溴水反应,原因不完全相同 |
| C.都不能发生消去反应,原因相同 |
| D.遇FeCl3溶液都显色,原因相同. |