使用容量瓶配制溶液,下列操作不正确的是( )
| A.使用容量瓶前检查它是否漏水 |
| B.容量瓶用蒸馏水洗净后,再用待配溶液润洗 |
| C.盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次 |
| D.容量瓶不能长期存放配制好的溶液 |
关于平衡常数,下列说法不正确的是
| A.平衡常数不随反应物或生成物的浓度的改变而改变 |
| B.平衡常数随温度的改变而改变 |
| C.平衡常数随压强的改变而改变 |
| D.使用催化剂不能使平衡常数增大 |
在容积为2 L的密闭容器中充入2 mol SO2和一定量O2,发生反应2SO2+O2 2SO3,当反应进行到4 min时,测得n(SO2)="0.4" mol。若反应进行到2 min时,容器中SO2的物质的量是
2SO3,当反应进行到4 min时,测得n(SO2)="0.4" mol。若反应进行到2 min时,容器中SO2的物质的量是
| A.等于1.6 mol | B.等于1.2 mol |
| C.大于1.6 mol | D.小于1.2 mol |
下列热化学方程式正确的是(△H的绝对值均正确)
| A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g) △H=-1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l) △H= +57.3kJ/mol(中和热) |
| C.S(s)+O2(g)===SO2(g) △H=-269.8kJ/mol(反应热) |
| D.2NO2==O2+2NO △H= +116.2kJ/mol(反应热) |
某绝热恒容容器中充入2mol/LNO2,发生反应2NO2 N2 O4 △H=" —56.9kJ/mol" 下列分析不正确的是
N2 O4 △H=" —56.9kJ/mol" 下列分析不正确的是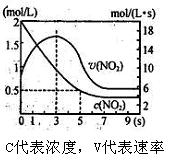
| A.5s 时NO2的转化率为75% |
| B.0 —3s 时v(NO2 )增大是由于体系温度升高 |
| C.3s 时化学反应处于平衡状态 |
| D.9s 时再充入N2 O4,平衡后平衡常数K 较第一次平衡时大 |
室温下,将一元酸HA 的溶液和KOH 溶液等体积混合(忽略体积变化)实验数据如下表:
| 实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+ ) > c(A— ) > c(OH— ) > c(H+ )
B.实验①反应后的溶液中:c(OH— ) = c(K+ ) — c(A— ) = 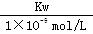
C.实验②反应后的溶液中:c(A—) + c(HA) > 0.1 mol/L
D.实验②反应后的溶液中:c(K+ ) = c(A— ) > c(OH—) = c(H+ )