实验室可用如下装置检验木炭和浓硫酸反应生成的气体产物。

试回答下列问题:
(1)仪器装配后,进行检验实验前,需要进行的操作是__________;
(2)图1的A中可选用图2中的装置__________(填序号);
(3)图1的B装置所装试剂是__________,目的是_______________;
(4)C装置中试剂的作用是___________;
(5)证明反应产物中含有二氧化碳气体的现象是_________________;
(6)这套装置存在的缺陷是__________,请提出改进意见______________。
农民使用的氮肥主要是“氢铵”和尿素。某化学兴趣小组对某“氢铵”化肥进行了专项研究: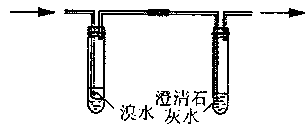
(1)预测:根据已有知识和“氢铵”的名称,该小组预测该“氢铵”是碳酸或亚硫酸或硫酸的铵盐。
(2)验证和探究:①NH4+的验证:取少量固体药品于试管中,然后。
②阴离子的探究: a.取少量固体药品于试管中,然后向试管中滴加稀盐酸,固体全部溶解,将
产生的气体通入下列装置。观察到的现象是:溴水无明显变化,澄清石灰水变浑浊。
再向滴加稀盐酸反应后的试管中,加Ba(OH)2溶液,无明显现象。
Ⅰ.初步结论:“氢铵”是的铵盐。
Ⅱ.要进一步确定“氢铵”的成分还需要补做如下实验:取适量“氢铵”配制成溶液,取试液于一支洁净的试管中,。
(3)该实验小组设计了以下二个实验方案测定该化肥的含氮量,请你阅读后解释方案中提出的问题并进行评价:
方案(一):准确称取一定质量的样品,放入上图方案(一)的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图装置,通过实验测定烧杯增加的质量(忽略漏斗中附着溶液的质量)。然后进行计算,可得化肥的含氮量。
方案(二):准确称取一定质量的样品,放入上图方案(二)的烧瓶中,滴加过量NaOH浓溶液,充分微热,按如图装置(A管可以上下移动),测量生成的氨气体积(设所测体积为标准状况下的体积)。然后进行计算,可得化肥的含氮量。
方案(二)图中导管a的作用是。
请你评价上述两套方案是否合理。若合理只需要说明结论;若不合理,请简要说明原因,并指出修改方案(若要添加仪器、药品,请说明添加的位置、名称)
方案(一):
方案(二):
氮是地球上含量丰富的一种元素,氮及其化合物在生产、生活中有着重要作用。
(1)下图是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2气体和CO反应的热化学方程式:。
(2)在固定体积的密闭容器中,进行如下化学反应: N2(g) +3H2(g) 2NH3(g);
2NH3(g);
①下列各项能说明该反应一定达到平衡状态的是(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(H2)(逆) =)3v(N2)(正)
c.容器内压强保持不变 d.混合气体的密度保持不变
②若上述反应达到平衡时,N2、H2、NH3的浓度之比为1:3:2,再向容器中按物质的量之比为1:3:2通入N2、H2、NH3,与原平衡相比,N2的物质的量浓度(填增大、不变或减小,下同),NH3的体积分数。
(3)科学家一直致力研究常温、常压下“人工固氮”的新方法。请回答下列问题:
目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g);△H<0。
2NH3(g);△H<0。
①下图表示随条件改变,平衡混合气体中氨气的百分含
量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号,下同)_____________;当横坐标为温度时,变化趋势正确的是_________________。
②液氨与水相似,存在着微弱的电离,写出液氨发生电离的方程式: ___________________________
下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L H2SO4溶液和NaOH溶液。填写下列空白: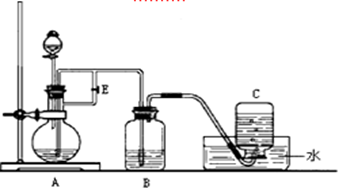
(1)B中盛有一定量的,A中应预先加入的试剂是,A中反应的化学方程式为。
(2)实验开始时应先将活塞E(填“打开”或“关闭”),目的是。
(3)A反应一段时间后将活塞E(填“打开”或“关闭”),目的是
。
(4)实验结束,拔去装置B中的橡皮塞,使空气进入,Fe(OH)2被氧化。若反应过程中转移了0.04mol电子,则参加反应的氧气的体积为L(标准状况)。
用18mol/L 浓硫酸配制100ml 3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积,②量取一定体积的浓硫酸,③溶解,④检漏、转移、洗涤,⑤定容、摇匀。回答下列问题:
(1)所需浓硫酸的体积是(保留到小数点后一位),量取浓硫酸所用的量筒的规格是(从下列中选用:A. 10ml B. 25ml C. 50ml D. 100ml)
(2)在上述实验步骤中,需要用到 玻璃棒的有(填序号)。
玻璃棒的有(填序号)。
(3)第⑤步实验的操作是:继续向容量瓶注入蒸馏水至离刻度线1-2cm处,改用胶头滴管向容量瓶滴加至为止。塞紧瓶塞,倒转摇匀。
(4)下列情况对所配制的稀硫酸浓度有何影响?(填“偏大”、“偏小”或“无影响”)
A. 所用的浓硫酸长时间放置在密封不好的容器中
B. 容量瓶用蒸馏水洗涤后残留有少量的水
C. 所用过的烧杯、玻璃棒未洗涤
D. 定容时俯视溶液的凹液面
工业上常用大理石等原料制取安全无毒的杀菌剂过氧化钙(CaO2)。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

 (1)溶解大理石时,用硝酸而不用硫酸的原因是
(1)溶解大理石时,用硝酸而不用硫酸的原因是
。 (2)操作Ⅱ中加入的A是少量的氨水,其目的是。
(2)操作Ⅱ中加入的A是少量的氨水,其目的是。 (3)写出滤液B的一种用途:。
(3)写出滤液B的一种用途:。 (4)写出检验滤液B中是否含Fe3+的方法是
(4)写出检验滤液B中是否含Fe3+的方法是 。
。
 (5)写出加入碳酸铵所发生反应的离子方程式:。
(5)写出加入碳酸铵所发生反应的离子方程式:。
(6)CaO2与水反应会放出氧气,化学方程式为。