在200mL0.5mol/L的氯化铝溶液中滴加0.5mol/L的氢氧化钠,得到3.9g的沉淀,求加入氢氧化钠的溶液的体积可能是多少?
A、B、C为三种链烃,其碳原子数有如下组合:
| 组别 |
碳原子数 |
||
| A |
B |
C |
|
| ① |
3 |
3 |
6 |
| ② |
3 |
3 |
4 |
| ③ |
1 |
4 |
5 |
| ④ |
2 |
4 |
4 |
| ⑤ |
5 |
2 |
7 |
| ⑥ |
2 |
2 |
4 |
试回答下列问题:
(1)若B、C为烷烃,且在一定条件下C可分解(裂化)为A和B,则满足此条件的可能组别是(填组别序号)。
(2)若组别⑥中A为烷烃,B为炔烃,C为烯烃,且A、B、C三种物质按物质的量1︰1︰2混合,取标准状况下该混合物和过量O2组成的混合气体840mL,电火花点燃,将燃烧后的产物用过量碱石灰吸收,碱石灰增重0.93g。求:碱石灰吸收后所剩气体在标准状况下的体积。
(9分)一定温度下有反应2NO2(g)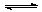 2NO(g)+O2(g)。将1molNO2、0.2molO2和一定量的NO通入容积为2L的密闭容器内反应,10min后反应恰好达到平衡状态,此时容器内有0.6molNO,容器内压强为原来的8/7。计算:(要求有计算过程)
2NO(g)+O2(g)。将1molNO2、0.2molO2和一定量的NO通入容积为2L的密闭容器内反应,10min后反应恰好达到平衡状态,此时容器内有0.6molNO,容器内压强为原来的8/7。计算:(要求有计算过程)
(1)用NO浓度表示的平均化学反应速率;
(2)NO2的分解率;
(3)该反应的平衡常数。
平达喜是常用的中和胃酸的药物,它的化学成分是铝和镁的碱式碳酸盐,其中氢元素的质量分数为0.040。取该碱式盐3.01g,加入2.0mol·L-1盐酸使其溶解,当加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全。若在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤,沉淀物进行干燥后重1.74g。试通过计算推测该碱式盐的化学式。
 某有机物组成中含碳54.5%, 含氢9.1%,其余为氧,又知其蒸汽在标准状况下的密度为3.94 g/L,试求其分子式。
某有机物组成中含碳54.5%, 含氢9.1%,其余为氧,又知其蒸汽在标准状况下的密度为3.94 g/L,试求其分子式。
向碘化钾溶液中加入硝酸银溶液,直到完全反应。结果反应后溶液的质量恰好等于原碘化钾溶液的质量,求该硝酸银溶液的质量分数?