在溶液中能大量共存的一组离子是
| A.K+、H+、ClO-、CO32- | B.NH4+、K+、OH-、NO3- |
| C.H+、Mg2+、MnO4-、SO42- | D.Fe3+、Na+、I-、Cl- |
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中不正确的是 ( )。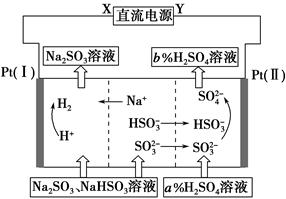
| A.X为直流电源的正极,Y为直流电源的负极 |
| B.阴极的电极反应式为2H++2e-=H2↑ |
| C.该过程中的产品主要为H2SO4和H2 |
| D.图中的b>a |
甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能。乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水。下列说法中不正确的是 ( )。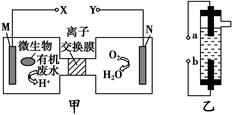
| A.装置乙的a极要与装置甲的X极连接 |
| B.装置乙中b极的电极反应式为2Cl--2e-=Cl2↑ |
| C.若有机废水中主要含有葡萄糖,则装置甲中M极发生的电极应为C6H12O6+6H2O-24e-=6CO2↑+24H+ |
| D.N电极发生还原反应,当N电极消耗5.6 L(标准状况下)气体时,则有2NA |
个H+通过离子交换膜
CO无色无味有毒,世界各国每年均有不少人因CO中毒而失去生命。一种CO分析仪的工作原理如图所示,该装置中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法中错误的是 ( )。
| A.负极的电极反应式为CO+O2--2e-=CO2 |
| B.工作时电极b作正极,O2-由电极a向电极b移动 |
| C.工作时电子由电极a通过传感器流向电极b |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH2=-1 160 kJ·mol-1
若在标准状况下用CH4还原4.48 L NO2生成N2,则下列说法中正确的是
( )。
| A.该过程吸收的热量为86.7 kJ |
| B.此过程中需要标准状况下CH4气体1.12 L |
| C.转移的电子数为0.8NA |
| D.已知2NO(g)+O2(g)=2NO2(g) ΔH=-114 kJ·mol-1,则CH4的燃烧热是802 kJ·mol-1 |
已知:H+(aq)+OH-(aq)=H2O(l) ΔH1=-57.3 kJ·mol-1,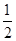 H2SO4(浓,aq)+NaOH(aq)=
H2SO4(浓,aq)+NaOH(aq)=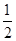 Na2SO4(aq)+H2O(l) ΔH2=m kJ·mol-1。下列说法正确的是 ( )。
Na2SO4(aq)+H2O(l) ΔH2=m kJ·mol-1。下列说法正确的是 ( )。
| A.上述热化学方程式中的化学计量数表示分子个数 |
| B.ΔH1>ΔH2 |
| C.ΔH2=-57.3 kJ·mol-1 |
| D.|ΔH1|>|ΔH2| |