NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,3.36L氧气与3.2g硫反应,生成SO2分子数为0.1NA |
| B.1L0.1mol∙L-1氨水中NH3∙H2O分子数为0.1NA |
| C.标准状况下,1.12LCl2发生反应转移的电子数一定为0.1NA |
| D.10g46%酒精(C2H5OH)中含氧原子总数为0.1NA |
 U是重要的核工业原料,在自然界的丰度很低。
U是重要的核工业原料,在自然界的丰度很低。 U的浓缩一直为国际社会关注。下列有关
U的浓缩一直为国际社会关注。下列有关 U说法正确的是
U说法正确的是
A. U原子核中含有92个中子 U原子核中含有92个中子 |
B. U原子核外有143个电子 U原子核外有143个电子 |
C. U与 U与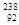 U互为同位素 U互为同位素 |
D. U与23892U互为同素异形体. U与23892U互为同素异形体. |
下列装置所示的实验中,能达到实验目的的是
下列各组物质的熔点变化规律,与它们的化学键无关的是
| A.F2、Cl2、Br2、I2的熔点依次升高 |
| B.Li、Na、K、Rb的熔点依次降低 |
| C.NaF、NaCl、NaBr、NaI的熔点依次降低 |
| D.晶体硅、碳化硅、金刚石熔点依次升高 |
祖母绿是含铬(以Cr2O3形式存在)等微量元素的矿物,其主要成分为Be3Al2Si6O18
(Be3Al2Si6O18为无色透明),下列说法不正确的是
| A.祖母绿是一种硅酸盐矿物 |
| B.其主要成分可用氧化物形式表示:3BeO·Al2O3·6SiO2 |
| C.绿色是Cr2O3表现出来的 |
| D.祖母绿是多种氧化物组成的混合物 |
某无色溶液,仅由Na+、Ag+、Ba2+、Al3+、AlO2─、MnO4─、CO32─、SO42─中的若干种组成。取该溶液进行如下实验:⑴取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;⑵在⑴所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;⑶在⑵所得溶液中加入过量Ba(OH)2溶液也有气体生成,同时析出白色沉淀乙。则下列离子在原溶液中一定存在的有
| A.SO42-、AlO2─、Na+、CO32─ | B.CO32─、Na+、Al3+ |
| C.Na+、CO32─、AlO2─ | D.MnO4─、Na+、CO32─ |