实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是( )
A.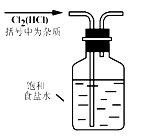 除去混有的杂质气体 |
B. 浓硫酸稀释 |
C. 分离出AgNO3溶液中的AgCl |
D. |
称量30.46g的NaOH固体
下列装置或操作能达到实验目的的是
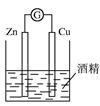
| A.除去乙醇中的乙酸 | B.形成原电池 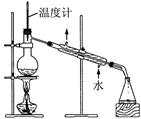 |
| C.制取乙酸乙酯 | D.石油的蒸馏 |
下列气态氢化物最稳定的是
| A.HCl | B.HBr | C.HF | D.H2O |
下列物质中含有共价键的离子化合物的是
| A.KOH | B.NaCl | C.CO2 | D.CH4 |
下列化学用语正确的是
A.氯化钠的电子式: |
B.乙炔的结构式:H-C=C-H |
C.磷原子的结构示意图: |
D.乙酸的分子式:C2H4O2 |
下列ETH天文研究所报告,组成太阳的气体中存在20Ne和22Ne,下列关于20Ne和22Ne的说法正确的是
| A.20Ne和22Ne互为同位素 | B.20Ne和22Ne互为同分异构体 |
| C.20Ne和22Ne的质量数相同 | D.20Ne和22Ne的中子数相同 |