研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g)时,放出135kJ的热量,则此反应的热化学方程式为______________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体,用CO(g)处理NO2(g)的能量转化关系如图所示。

标准状况下,22.4LCO和NO2发生上述反应。整个过程中,转移电子的物质的量为___________mol,放出的热量为___________kJ(用含有a的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1="-574kJ/mol"
② CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
若1molCH4(g)直接将NO2(g)还原至N2(g),整个过程中放出的热量为867kJ,则△H2=_____________。
研究钢铁的腐蚀与防护具有非常重要的意义。
(1)铁的电化学腐蚀包括两种,这两种腐蚀的负极反应均为,而正极反应由铁表面的水膜酸碱性决定,当水膜酸度较高时,正极反应式为,这种腐蚀称为腐蚀,而水膜酸性不强时,正极反应式为,这种腐蚀称为腐蚀。
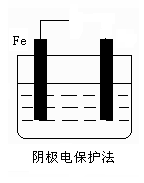
(2)防止钢铁腐蚀的电化学方法有两种,下图中液体为海水,请在图中添加必要的导线、电源,注明另一电极的电极材料名称,使其符合图下所注的保护方法: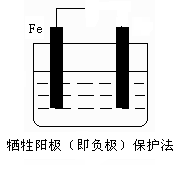
化学电源在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O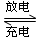 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是(填序号)
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是(填序号)
①以上反应不是可逆反应②电解质溶液为硫酸
③充电时化学能转变为电能④镉(Cd)为负极,发生还原反应
⑤放电时正极区pH升高
(2)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源。氢氧燃料电池的突出优点是把化学能直接转化为电能,而不经过热能中间形成,发生的反应为: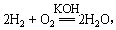 则负极反应式为_________________,正极反应式为。一段时间后,KOH溶液的浓度(填“变大”、“变小”或“不变”)
则负极反应式为_________________,正极反应式为。一段时间后,KOH溶液的浓度(填“变大”、“变小”或“不变”)
如右图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,填空:
(1)电源A上的a为________极
(2)滤纸B上发生的总化学方程式为:__________________
(3)欲在电镀槽中实现铁上镀铜,接通K点,使c、d两点短路,则电极e上发生的反应式为:_______________,电极f上发生的反应式为:______________。若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为3.84 g,则电镀时电路中通过的电子为__________mol。
在用惰性电极电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,下列物质中不能选用的是(填序号)
| A.NaOH | B.H2SO4 | C.Na2SO4 | D.CuSO4 |
不能选用上述某物质的原因是(用电极反应式及总反应式表示,若不止一种物质可添加空格填写):
阳极反应式,
阴极反应式,
总反应的离子方程式。
写出下列热化学方程式:
(1)SiH4是一种无色的气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O,已知室温下2g SiH4自燃放出热量89.2kJ,其热化学方程式为:;
(2)在25℃、101kPa下,在稀溶液中,强酸强碱反应生成1mol 液态水放热57.3kJ。写出稀硫酸与烧碱溶液反应的热化学方程式_________________________;
(3)已知60g C(s)与高温水蒸气反应制取CO和H2时吸收657.5KJ热量,写出热化学方程式。