下列反应中,离子方程式为H++OH-===H2O的是
| A.CH3COOH+NaOH===CH3COONa+H2O |
| B.HNO3+KOH===KNO3+H2O |
| C.H2SO4+Ba(OH)2===BaSO4↓+2H2O |
| D.2HCl+Cu(OH)2===CuCl2+2H2O |
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)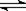 Ni(CO)4(g),已知该反应的平衡常数与温度的关系如下表:
Ni(CO)4(g),已知该反应的平衡常数与温度的关系如下表:
| 温度/℃ |
25 |
80 |
230 |
| 平衡常数 |
5×104 |
2 |
1.9×10-5 |
下列说法不正确的是
A.上述生成Ni(CO)4的反应为放热反应
B.在80 ℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时v正>v逆
C.25 ℃时反应Ni(CO)4(g) 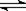 Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
D.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1
稀氨水中存在着下列平衡:NH3·H2O NH+OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是
NH+OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgSO4固体
| A.①②③⑤ | B.③⑥ | C.③ | D.③⑤ |
在密闭容中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.A的转化率变小 | B.平衡向正反应方向移动 |
| C.D的体积分数变大 | D.a > c+d |
一定条件下,对于可逆反应X(g)+3Y(g)  2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
| A.c1∶c2=3∶1 |
| B.平衡时,Y和Z的生成速率之比为2∶3 |
| C.X、Y的转化率不相等 |
| D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1 |
下列生产或实验事实引出的相应结论不正确的是
| 选项 |
事实 |
结论 |
| A |
其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 |
当其他条件不变时,升高反应温度,化学反应速率加快 |
| B |
工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 |
增大气液接触面积,使SO3的吸收速率增大 |
| C |
在容积可变的密闭容器中发生反应:2NH3(g) 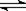 N2H4(l)+H2(g),把容积的体积缩小一半 N2H4(l)+H2(g),把容积的体积缩小一半 |
正反应速率加快,逆反应速率减慢 |
| D |
A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 |
当其他条件不变时,催化剂可以改变化学反应速率 |